- Paolo Onorato e Savino Russo
- Original Article
Monitoraggio clinico, cosa, come e con quali aspettative?
- 3/2017-Ottobre Supplemento
- ISSN 2532-1285
- https://doi.org/10.23832/ITJEM.2017.034
P. Onorato e S. Russo
Con monitoraggio, si definisce l’osservazione a scopo di controllo, di una grandezza variabile, eseguita tramite appositi dispositivi (monitor).
Il monitoraggio può essere:
- intermittente (ad es. rilevazione dei parametri vitali) o continuo (ad es. monitoraggio ECG);
- invasivo (qualora richieda il posizionamento di un catetere venoso centrale e/o una linea arteriosa) e non invasivo;
Le variabili che è possibile monitorare nel paziente settico o in generale critico si distinguono in1:
- statiche (ad es. Pressione Venosa Centrale, Pressione di incuneamento polmonare, misurazione in ecocardio dell’area telediastolica del ventricolo sinistro) o dinamiche (ad es. Pulse Pressure Variation o Stroke Volume Variation);
- macro (ad es. Stroke Volume) e micro parametri (ad es. variazione della concentrazione ematica dei lattati nel tempo).
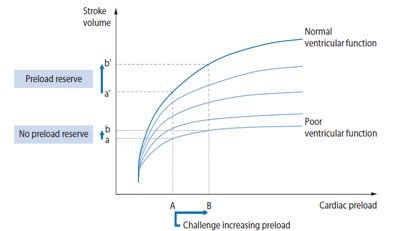
Parlando di monitoraggio emodinamico è inevitabile imbattersi nel concetto di fluid responsiveness: si definisce responsività ai fluidi la misura della riserva di pre-carico o della dipendenza dal pre-carico dei due ventricoli2. Un soggetto viene definito fluid responder se in seguito all’infusione di un carico di fluidi (250-500 cc) il suo Stroke Volume (SV) aumenta del 12-15%3.
Figura 1. Assessment of volume responsiveness during mechanical ventilation: recent advances Xavier Monnet, Jean-Louis Teboul. Monnet and Teboul Critical Care 2013,17:217.
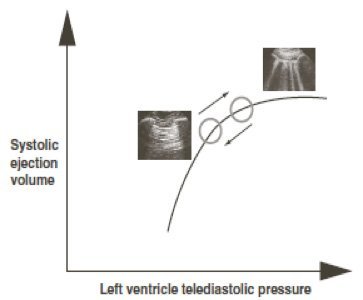
Il presupposto fisiopatologico della fluid responsiveness risiede nella curva di Frank Starling che illustra la relazione esistente tra pre-carico e gittata cardiaca (CO)4-5: in un cuore sano all’aumentare del pre-carico (ossia il grado di stiramento delle fibre miocardiche da parte del volume ematico telediastolico) tramite infusione di fluidi, lungo la porzione ripida della curva, la CO aumenta in virtù della sovrapposizione ottimale dei filamenti di actina e miosina; quando viene raggiunta la porzione “flat”, piatta, della curva ulteriori boli di fluidi non determinano un aumento della CO. Per ogni paziente, in relazione alle comorbilità ed alla patologia attuale, esistono differenti curve: pertanto pazienti con disfunzione sistolica di qualsivoglia origine portano a considerare una curva di Frank Starling caratterizzata da una minore pendenza e quindi la loro responsività a fluidi è ridotta.
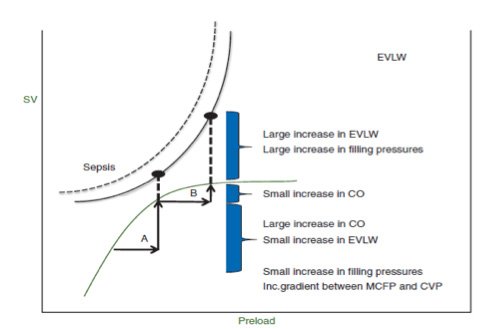
La somministrazione smodata di fluidi non è scevra da effetti collaterali: qualora venga somministrato un bolo di fluidi in pazienti con ridotta contrattilità cardiaca che si trovano nella porzione piatta della curva, si assiste ad un aumento della Pressione Venosa Centrale (PVC) con conseguente riduzione del ritorno venoso ed all’aumento dell’acqua intrapolmonare extravascolare (EVLW) con conseguente congestione polmonare. Nei pazienti settici il rischio di determinare con un carico di fluidi un aumento dell’EVLW è maggiore causa dell’aumentata permeabilità capillare (“leakege capillare”) che la caratterizza6.
Figura 2. A rational approach to fluid therapy in sepsis P. Marik and R. Bellomo British Journal of Anaesthesia, 116(3):339–49(2016).
La gestione della terapia con fluidi (aumento del pre-carico) ed eventuali amine (variazione della contrattilità miocardica) richiede, pertanto, per ciascun paziente, la conoscenza della specifica curva di contrattilità cui appartiene e lungo quale punto della curva si trova.
Bisogna aggiungere alcune premesse al concetto di fluid responsiveness: soltanto il 40% dei pazienti critici è fluid responder7-9; in modelli sperimentali di peritonite batterica meno del 5% del volume di fluidi infuso resta nel compartimento vascolare ad un’ora10 e, addirittura, soltanto il 15% nei soggetti sani a tre ore mentre il 50% si riversa nell’interstizio11-12. Inoltre va considerato che il concetto di fluid responsiveness si basa su considerazioni di carattere fisiopatologico ma non è stato rigorosamente studiato in trial randomizzati13.
Come valutiamo la fluid responsiveness e cosa monitoriamo? Possiamo ottenere molte informazioni sullo stato emodinamico del paziente settico direttamente “bedside”: in particolare specchio della perfusione14 sono lo stato di coscienza (quantificabile con il Glasgow Scale Score o più semplicemente con l’ AVPU), la diuresi (quantificabile previo cateterismo vescicale), la cute (in particolare il grado di marezzatura quantificabile con il “mottling score”15, la temperatura delle estremità e l’eventuale presenza di un gradiente tra la temperatura centrale e la temperatura delle estremità e la temperatura delle estremità e quella ambientale16), il tempo di riempimento capillare17 (RCT, normalmente < ai 2 secondi).
La clinica fornisce informazioni utili nella valutazione della perfusione del paziente ma non è altrettanto affidabile nella valutazione dello stato volemico e della fluid responsiveness: una recente review pubblicata su JAMA18 ha infatti citato due studi condotti rispettivamente su pazienti malarici19 e pazienti ricoverati in terapia intensiva per shock20, mostrando come i like odd ratio positivo e negativo di diversi rilievi obbiettivi (stato delle giugulari, stato di idratazione di cute e mucose etc.) siano prossimi ad 1 e pertanto assolutamente non dirimenti. I parametri vitali nel monitoraggio del paziente critico in qualsivoglia setting sono sicuramente utili: basti pensare che l’alterazione di un unico parametro vitale si associa ad una mortalità dello 0,92%, ma l’alterazione di tre parametri vitali si correla ad una mortalità del 23,6%21.
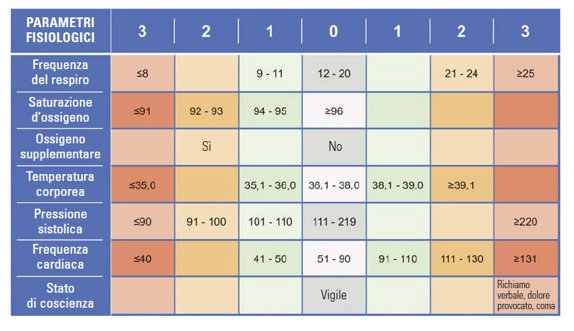
La combinazione di più parametri vitali pertanto è utile nel monitorare e riconoscere precocemente un paziente che si deteriora: questo concetto è ben noto in Inghilterra dove da anni è in uso il National Early Warning Score22, uno score costituito da più items (parametri vitali e stato di coscienza) che consente di adeguare per ogni singolo paziente il livello di monitoraggio e di intervento medico in relazione alla variazione nel tempo del punteggio.
Figura 3. National Early Warning Score (NEWS) standardising the assessment of acute-illness severity in the NHS. Royal College of Physicians July 2012
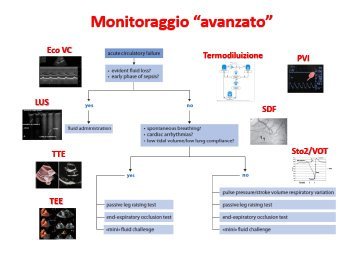
Se la clinica non è accurata nell’identificazione della fluid responsiveness, per la sua predizione è possibile combinare due metodiche23: una per indurre una variazione del pre-carico (ad es. fluid challenge8,24-25, Passive Leg Raising26, variazioni del pre-carico indotte dal respiro27 o l’End Expiratory Occlusion Test28), ed una per stimare l’effetto che tale variazione ha determinato sull’emodinamica del paziente.
Esiste un’ampia ed eterogenea gamma di strumenti29-40, strategie, più meno invasive, più o meno fruibili per la predizione della fluid responsiveness: ovviamente ogni setting ospedaliero (hub o spoke) e di reparto (dalla medicina generale alla terapia intensiva) offre a considerare diversa esperienza, skill, competenza e familiarità nel maneggiare queste diverse metodiche. Si distinguono metodiche di monitoraggio invasivo come la valutazione in continuo dello SV (LIDCO, PICCO, PICCO2, EV1000, Vigileo), della PPV, SVV41-42, la termodiluizione43 con stima dei volumi intratoracici (ITTV, ITBV, GEDV, EVLW), metodiche sperimentali e non standardizzate di valutazione diretta del microcircolo (visualizzazione del microcircolo sublinguale con Sidestream Dark Field (SDF) e luce ortogonale polarizzata (OPS)44-47, o la valutazione della saturazione tissutale con infrarossi (NIRS)48-49), la bioimpedenza e l’analisi vettoriale della bioimpedenza (BIVA)50, la variabilità dell’ampiezza dell’onda pletismografica durante il ciclo respiratorio51, ed infine l’ecografia mirata Point-Of-Care52-53 che ben si presta per maneggevolezza in un setting di PS (in particolare l’ecografia delle vene cave54-60, l’ecografia della vena giugulare interna61, la Lung Ultra Sound62 e l’ecocardio transtoracico63-67 o trans-esofageo68-69).
Dinanzi ad una così ampia scelta, con cosa dobbiamo valutare la fluid responsiveness? La consensus dell’ESCIM14, pubblicata nel 2014, sul monitoraggio emodinamico del paziente con shock non fornisce specifiche indicazioni ma afferma chiaramente che la fluidoterapia deve essere guidata dalla valutazione di più parametri emodinamici, che è preferibile affidarsi alle variabili dinamiche piuttosto che alle statiche (ad es. PAOP e PVC) e che la somministrazione dei fluidi deve avvenire secondo la tecnica del fluid challenge (infondere in 30 minuti un carico di fluidi di 250-500 cc e valutare la risposta emodinamica del paziente) a meno che non vi siano condizioni di chiaro shock ipovolemico (ad es. rottura di aneurisma dell’aorta addominale).
Figura 4. Assessment of volume responsiveness during mechanical ventilation: recent advances Xavier Monnet, Jean-Louis Teboul. Monnet and Teboul Critical Care 2013,17:217
Nel 2013 è stata pubblicata una metanalisi70 che ha valutato studi condotti sulle differenti metodiche di predizione e stima della fluid responsiveness: le conclusioni sono piuttosto scoraggianti, in quanto, nonostante la pletora di metodiche e strategie disponibili, si evidenzia una scarsa qualità degli studi soprattutto per quelli incentrati sulle metodiche non invasive e condotti in ambienti non intensivi. Va inoltre precisato che non necessariamente un paziente fluid responder ha bisogno di liquidi71 in quanto il semplice aumento dello SV ottenuto con la somministrazione di un carico di fluidi può non determinare un beneficio a livello del microcircolo: tipico della sepsi è il disaccoppiamento tra macroemodinamica e microcircolo, per cui un intervento medico capace di migliore i macroparametri emodinamici (ad es. pressione arteriosa, SV, saturazione in ossigeno del sangue periferico o centrale) non necessariamente favorisce il microcircolo72-73.
Se il concetto di fluid responsiveness può sollevare alcune perplessità ed elementi di critica, un concetto alternativo o integrativo alla fluid responsiveness nel guidare la fluidoterapia potrebbe essere quello di fluidotolleranza: piuttosto che chiederci se la somministrazione di un carico di fluidi determinerà un aumento della CO, potrebbe essere corretto valutare se tale intervento possa danneggiare il microcircolo ed aumentare o indurre un quadro di congestione polmonare.
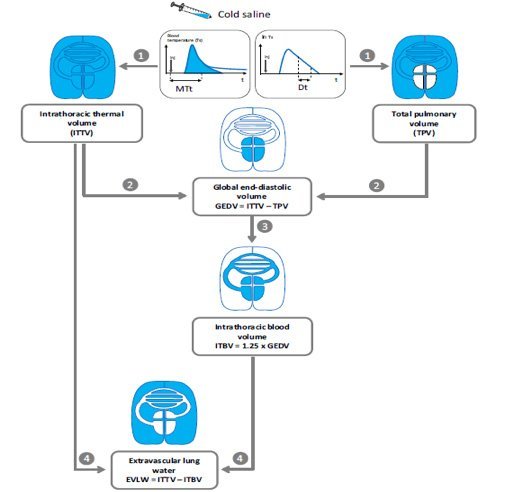
Un parametro che ben correla con la tolleranza polmonare alla somministrazione di fluidi è l’EVLW43,74-77 : gli effetti dell’edema interstiziale che si osserva in corso di sepsi ed eccessiva fluidoterapia (“overload” o quello che Marik ha definito come “iatrogenic salt water drowning”78-80) si ripercuotono soprattutto a livello polmonare. L’EVLW, ossia il contenuto in acqua del polmone a livello interstiziale, può essere quantificato con la termodiluizione, una metodica che prevede l’iniezione di un bolo di soluzione fisiologica in catetere venoso centrale e la stima della variazione di temperatura che esso determina tramite un termistore posto sulla sommità di un catetere arterioso posizionato in a. femorale: la curva che ne deriva consente di quantificare tramite diversi algoritmi il volume intratoracico complessivo (ITTV), quello intracardiaco (GEDV), quello intravascolare intrapolmonare (ITBV) ed infine l’EVLW.
L’EVLW nei soggetti sani è inferiore ai 7 ml/kg mentre in condizione di congestione polmonare raggiunge valori superiori a 15 ml/kg: il suo valore assoluto o indicizzato per il peso ideale o l’altezza del paziente si è dimostrato un importante fattore prognostico indipendente in quanto soggetti con valori di EVLW più alti presentano una mortalità elevata a 28 giorni. Quest’osservazione giustificherebbe pertanto l’impiego di strategie terapeutiche tendenti al raggiungimento di un bilancio dei fluidi negativo (regimi di fluidoterapia conservativi, infusione di diuretici, applicazione di PEEP elevate, ultrafiltrazione) attuando la cosiddetta “deresuscitation”.
Figura 5. Extravascular lung water in critical care: recent advances and clinical applications Mathieu Jozwiak, Jean‑Louis Teboul and Xavier Monnet Ann. Intensive Care (2015)5:38
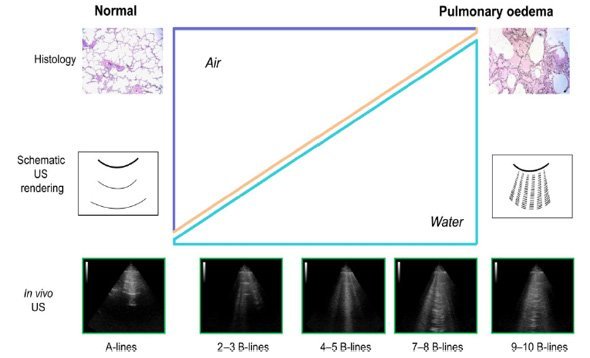
Una metodica non invasiva, ripetibile, maneggevole e altrettanto sensibile ed accurata per la stima dell’EVLW è rappresentata dalla Lung Ultra Sound (LUS)81-84: l’ecografia toracica è l’ecografia degli artefatti derivanti dalla variazione del rapporto aria/fluido all’interno del polmone. Il polmone normale presenta un rapporto aria/fluido pari a 0.9 con riscontro del classico A-profile caratterizzato dalla successione al di sotto della linea pleurica di linee orizzontali, linee A, equidistanti fra loro. Se il rapporto raggiunge l’unità ci troviamo di fronte ad uno pneumotorace mentre man mano che il rapporto diminuisce per aumento dell’acqua intrapolmonare o riduzione del contenuto aereo si passa alla sindrome interstiziale, caratterizzata dalla presenza di linee B, artefatti verticali, più o meno fitti che si distaccano dalla linea pleurica e si estendono in basso coprendo le linee A. Ulteriori aumenti dell’EVLW determinano un aumento del numero di linee B sino alla definizione di un addensamento polmonare o infine un versamento pleurico. L’identificazione del quadro ecografico di sindrome interstiziale presenta un’elevata sensibilità per l’aumento del contenuto in acqua intrapolmonare ancor prima che si verifichi una riduzione della PaO2, della saturazione in ossigeno o diventi clinicamente manifesto con un aumento della frequenza respiratoria e comparsa di dispnea.
Figura 6. Clinical update Ultrasound of extravascular lung water: a new standard for pulmonary congestion. E Picano and Patricia A. Pellikka, European Heart Journal Advance Access published May 12, 2016.
Pertanto l’ecografia toracica può guidarci nella somministrazione di fluidi in un paziente settico che si presume essere fluidoresponsivo riconoscendo precocemente la comparsa di congestione polmonare secondaria a overload di fluidi o peggioramento della sepsi tessa: man mano che si somministrano fluidi nel tentativo di incrementare la CO, scalando la curva di Frank-Starling, si può valutare in ecografia toracica la fluidotollerenza del paziente e verificare precocemente l’eventuale passaggio da un A-profile ad un B-profile o il peggioramento di un preesistente quadro di congestione polmonare.
Figura 7. Whole body Ultrasonography in the critical ill. Daniel A. Lichtenstein 2010
Ai fini della quantificazione dell’impegno interstiziale polmonare con la LUS la Consensus del 201262 suggerisce il ricorso a due schemi di scansione: il primo prevede lo studio ecografico di ciascun emitorace suddiviso in 8 quadranti, utilizzando come punti di repere le linee parasternale, ascellare anteriore, ascellare posteriore e l’intermammaria, mentre il secondo, più indaginoso, prevede la scansione di 28 regioni (16 a destra, 12 a sinistra) con conteggio complessivo del numero di linee B e definizione di uno score ecografico direttamente proporzionale al grado di congestione polmonare. Un interessante studio pubblicato su Critical Care nel 2015 ha confrontato per la stima dell’EVLW la termodiluizione e la LUS85: in particolare è stato adottato uno schema di scansione ancora più semplice che prevedeva l’esecuzione complessiva di 4 scansioni ecografiche longitudinali (2 per emitorace) all’altezza di 3° spazio intercostale e 6° spazio intercostale lungo le linee parasternali ed il successivo conteggio delle linee B presenti.
Lo studio ha evidenziato l’esistenza di un’ottima correlazione tra termodiluizione e score ecografico nella quantificazione dell’EVLW: in particolare un valore allo score ecografico superiore a 1.5 si associa ad un EVLW superiore a 7 ml/Kg mente un valore allo score ecografico superiore a 18.5 identifica un EVLW superiore a 15 ml/Kg.
Il LUS score si presta ad ulteriori e variegati utilizzi: in letteratura esistono studi che ne hanno mostrato l’affidabilità per la valutazione dell’evoluzione delle polmonite per guidare la de-escalation dell’antibioticoterapia, per la valutazione del reclutamento polmonare tramite applicazione di una PEEP nei pazienti in ARDS, per la valutazione del rischio di fallimento di svezzamento dalla IOT, per la valutazione del rischio di evoluzione in ARDS nei pazienti con trauma toracico86-92.
Figura 8. Lung ultrasound in the ICU: from diagnostic instrument to respiratory monitoring tool G. VIA, E. STORTI, G. GULATI, L. NERI, F. MOJOLI, A. BRASCHI MINERVA ANESTESIOLOGICA Vol. 78 – No.11
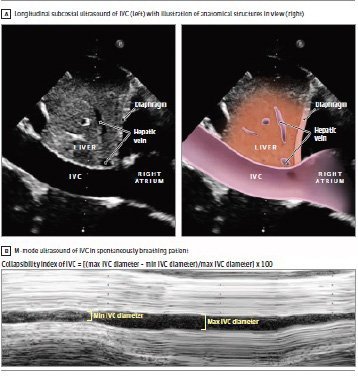
Una metodica ecografica che ha riscosso molto successo nella valutazione della fluid responsiveness è l’ecografia della vena cava inferiore: la VCI viene visualizzata nel suo tratto subfrenico, intra-addominale, tramite una scansione longitudinale con sonda convex o ecocardiografica in sottocostale e si presenta con l’aspetto di un tubo a sezione ellissoidale alle spalle del I segmento epatico che “sfocia” nell’atrio destro. Il suo diametro antero-posteriore viene misurato secondo le linee guida dell’AHA del 2010 sullo studio ecocardiografico del ventricolo destro a circa 0.5-3 cm dallo sbocco in atrio destro, distalmente allo sbocco delle vene sovra epatiche, ed oscilla tra 1.5 e 2.5 cm. In respiro spontaneo il diametro della VCI varia di circa il 50%: durante l’inspirazione la pressione intratoracica diminuisce, la pressione intra-atriale destra diminuisce favorendo il ritorno venoso, la VCI intraddominale viene “strizzata” dal diaframma con conseguente riduzione di calibro, mentre durante l’espirazione si dilata. La variazione di diametro, calcolata come rapporto tra la differenza tra il diametro massimo espiratorio ed il diametro minimo inspiratorio e diametro massimo espiratorio (Dmax espiratorio-Dmin inspiratorio/Dmax espiratorio) o la media tra i due diametri (Dmax espiratorio-Dmin inspiratorio/Dmedia) corrisponde all’indice di collassabilità. In caso di applicazione di una pressione di fine espirazione estrinseca (PEEP) il comportamento della VCI si inverte: per effetto della PEEP la VCI intratoracica viene compressa, la pressione intra-atriale meno negativa rallenta il ritorno venoso con conseguente ingorgo ematico a carico della VCI intraddominale. Pertanto in corso di ventilazione meccanica la VCI si dilata durante l’inspirazione e tende a collassare in espirazione: in luogo dell’indice di collassabilità verrà calcolato l’indice di distensibilità (Dmax inspiratorio-dmin inspiratorio/ d max inspiratorio o D media).
Figura 9. Will This Hemodynamically Unstable Patient Respond to a Bolus of Intravenous Fluids? Peter Bentzer, MD, PhD; Donald E. Griesdale, MD, MPH; John Boyd, MD, JAMA
L’utilizzo della VCI e delle variazioni respiratorie del suo diametro come parametro di fluid responsiveness affonda le radici in due studi condotti su pazienti ricoverati in terapia intensiva, intubati ed in ritmo sinusale: il primo studio di Barbier54 ha dimostrato che un paziente con un indice di distensibilità della VCI del 18% identifica un fluid responder (responsivo a bolo di Voluven con aumento dello SV del 15%) con una sensibilità ed una specificità del 90%, mentre lo studio di Feissel55 ha dimostrato, in analoghe condizioni, che un’ indice di distensibilità del 12% identifica un fluid responder con un valore predittivo positivo del 93% ed un valore predittivo negativo del 92%.
Purtroppo l’affidabilità della VCI in respiro spontaneo è nettamente inferiore: uno studio condotto su pazienti ricoverati in terapia intensiva per differenti cause di ipovolemia (settici, emorragici, disidratati) né il diametro basale, né la variazione respiratoria del diametro della VCI sembrano costituire un buon parametro di valutazione della fluid responsiveness. In particolare un indice di collassabilità >42% identifica i pazienti che dopo bolo di cristalloidi vanno incontro ad un incremento della CO >10% con una sensibilità bassa (31%), specificità del 97%, VPP 90%57. Un altro recente studio pubblicato su Critical Care58 ha mostrato come nei pazienti a respiro spontaneo con shock a differente patogenesi l’indice di collassabilità non è utile per predire correttamente la fluid responsiveness: valori >40% sono compatibili con fluido responsività, ma se < 40% non la escludono. La VCI in respiro spontaneo sembra lavorar bene per la stima della fluid responsiveness se piccola e con elevato indice di collassabilità: questa scarsa affidabilità rispetto a quanto rilevato nei pazienti intubati sembra essere correlata alla variabilità della frequenza e dell’ampiezza del respiro cui va aggiunta la variabilità del riempimento diastolico in corso di aritmia (fibrillazione atriale).
A lungo abbiamo ragionato secondo la logica del pieno/vuoto: una VCI piccola e collassante costituiva un sinonimo di paziente “vuoto” mentre una VCI dilatata e ipocollassante caratterizzava il paziente “pieno”: se la prima affermazione è attualmente condivisibile, la seconda è parzialmente vera. Esistono infatti svariate condizioni patologiche in grado di influenzare il grado di collassabilità della VCI: in particolare, in presenza di patologie determinanti un aumento della PVC (pneumotorace iperteso, tamponamento cardiaco, applicazione di una PEEP, cuore polmonare cronico, infarto del ventricolo destro, embolia polmonare, insufficienza tricuspidalica severa, contusione cardiaca, ARDS, sindrome compartimentale addominale) la VCI si dilatata e risulta ipocollassante, ma ciò non esclude che il paziente sia fluidoresponsivo. Infine la già citata recente review pubblicata su JAMA conclude che l’indice di distensibilità della VCI in pazienti intubati è un buon predittore di fluid responsiveness con un LR positivo di 5.3 e negativo di 0.27 mentre in respiro spontaneo, utilizzando un cut-off del 40%, va interpretato con cautela e sempre inserito nel contesto clinico18.
La visualizzazione della VCI non è sempre ottimale o possibile: il 10% dei pazienti non presenta una buona finestra ecografica per meteorismo, obesità, trauma, dolore. La vena giugulare interna, pertanto, si presenta come un’interessante alternativa: uno studio del 201461 in particolare, condotto sempre su pazienti intubati, ha confrontato la PPV con l’indice di distensibilità della VGI. La visualizzazione della VGI in scansione trasversale su pazienti con capo inclinato di 30° ha previsto il ricorso ad un approccio laterale per evitare di comprimere il vaso: lo studio ha dimostrato come un indice di distensibilità > 18% si associa ad una sensibilità dell’80% ed una specificità del 95% per la predizione della fluid responisveness. Inoltre l’associazione di un indice di distensibilità superiore a 9.9% e di una PPV superiore al 12% si correla ad una sensibilità del 100% ed una specificità del 95%. Interessante in questo studio è la combinazione di due metodiche finalizzate alla valutazione della fluid responsiveness dei due singoli ventricoli. Purtroppo le esperienze e gli studi sull’utilizzo della variazione del calibro della VGI in pazienti in respiro spontaneo è limitata a pochi studi dai risultati assai discordanti.
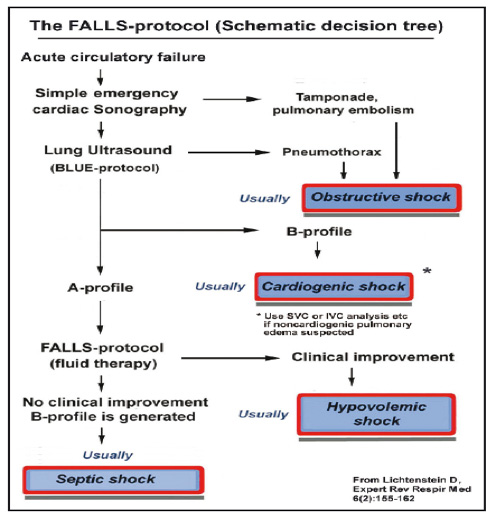
Esistono algoritmi di gestione emodinamica del paziente settico basati sulla combinazione delle informazioni ottenibili dalla LUS e dall’ecografia della VCI. Lichtenstein nel 2009 ha proposto il FALLS protocol93.
Esso prevede:
-
l’esecuzione in prima istanza di una valutazione ecocardiografica semplice ed ispettiva atta ad escludere cause di shock ostruttivo (in particolare cuore polmonare acuto secondario a embolia polmonare e tamponamento cardiaco);
-
in seconda battuta si esegue una LUS ed escluso lo pneumotorace si valuta la presenza e l’entità della congestione polmonare: in presenza di un B-profile sospetteremo un quadro di edema polmonare acuto in shock cardiogeno o eventualmente un’ARDS in base al tipo di impegno interstiziale (diffuso omogeneo o diffuso disomogeneo con “skip areas”) e ai dati desunti dall’ecografia della VCI (piccola o dilatata, collassante o non collassante in inspirio) ed ispettiva del cuore (disfunzione sistolica globale, dissincronia di uno o più segmenti, ipertrofia ventricolare compatibile con disfunzione diastolica) limitando la somministrazione di fluidi. In assenza di linee B si è giustificati somministrando boli di fluidi secondo la tecnica del fluid challenge e valutando di volta in volta il quadro polmonare e la risposta emodinamica del paziente: in caso di miglioramento della perfusione del paziente e di mancato riscontro di congestione polmonare probabilmente il quadro di shock è secondario a ipovolemia mentre in caso di mancato miglioramento della perfusione e/o comparsa di congestione polmonare ci si troverà dinanzi ad uno shock settico.
Figura 10. FALLS-protocol: lung ultrasound in hemodynamic assessment of shock D. Lichtenstein Heart,LungandVessels.2013;5(3):142-147
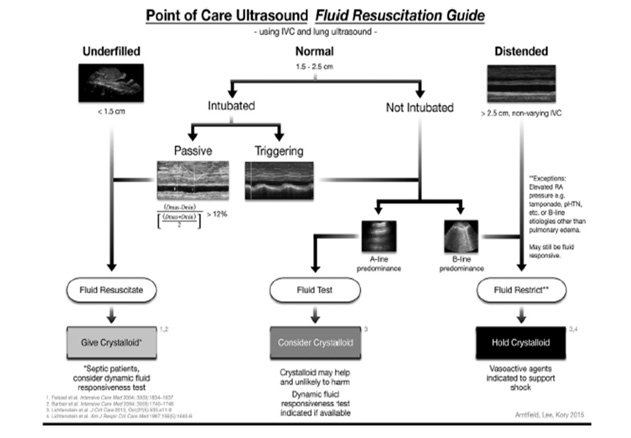
Un’altra proposta interessante di algoritmo di gestione emodinamica ecoguidata del paziente settico è illustrata in un articolo del 2016 pubblicato sul Journal of Critical Care94: se la VCI presenta un diametro antero-posteriore < a 1.5 cm siamo giustificati a somministrare fluidi mentre se dilatata con un diametro antero-posteriore > a 2.5 cm, escluse le cause di shock ostruttivo, si valuta la presenza di congestione polmonare. In presenza di linee B si sospende la somministrazione di fluidi e si considera l’infusione di amine (noradrenalina come prima scelta).
Quando il calibro è normale (1.5-2.5 cm) e non dirimente si valuta il quadro polmonare ed in base alla presenza di linee B o meno si considera l’opportunità di eseguire un fluid challenge test.
Figura 11. Development of a fluid resuscitation protocol using inferior vena cava and lung ultrasound ChristopherW.C. Lee, MD, BASc, Pierre D. Kory, MPA, MD, Robert T. Arntfield, MD, FRCPC Journal of Critical Care 31(2016)96–100
Il grosso limite di entrambi i protocolli è rappresentato dal fatto che la somministrazione di fluidi è vincolata alla presenza di un A-profile: se la sepsi è a partenza polmonare (molto frequente), bisognerà tener conto che il polmone del paziente presenterà già alterazioni almeno focali che potrebbero inficiare l’effettiva stima del quadro di congestione polmonare. Questo ostacolo può però essere superato valutando il LUS score e le sue variazioni nel tempo dopo ogni intervento terapeutico. Va inoltre precisato che è possibile rilevare la presenza di linee B nelle aree più declivi del polmone (segmenti basali e posteriori) già in condizioni fisiologiche o possono essere frutto dell’atelettasia secondaria al semplice e prolungato clinostatismo: pertanto è preferibile ricorrere a modelli di scansione che privilegino le aree più ante declivi del torace.
In conclusione è necessario ribadire che nella valutazione emodinamica del paziente critico e nella gestione della fluidoterapia l’affidarsi alla valutazione di un unico parametro si associa inesorabilmente ad una prognosi sfavorevole: come ogni atto medico la fluido terapia deve essere ben ponderata sulla base di una valutazione multiparametrica (integrazione di più metodiche) e quindi dei rischi e dei benefici associati ad un dato contesto clinico.
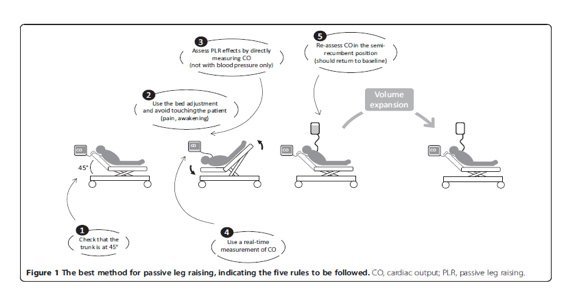
Figura 12. Passive leg raising: five rules, not a drop of fluid! Xavier Monnet and Jean-Louis Teboul Critical Care (2015) 19:18 DOI 10.1186/s13054-014-0708-5
Appendice
Un’alternativa al fluid challenge per l’induzione di una variazione del pre-carico è rappresentato dal Passive Leg Raising26: trattasi di una manovra sovrapponibile ad un’”autotrasfusione” realizzabile semplicemente sollevando gli arti inferiori del paziente in posizione semiseduta inclinando il letto per alcuni minuti. Ciò determina il reclutamento di circa 300-500 cc di sangue “unstressed” senza infondere fluidi. La valutazione della fluid responsiveness può servirsi di una metodica di monitoraggio continuo ed invasivo dello SV (preferibile) o non invasiva (ecocardiografica) eseguita prima, durante e dopo la manovra ricordando che il massimo effetto emodinamico del PLR si realizza entro un minuto. Il PLR ha di limiti: non essere può effettuato in pazienti con trauma, sindrome compartimentale addominale, la presenza di dolore o discomfort riduce l’effetto di espansione volumetrica per attivazione catecolamminergica. I vantaggi sono la possibilità di esecuzione anche in presenza di aritmia, in respiro spontaneo e soprattutto l’induzione di una variazione del precarico senza somministrare fluidi eventualmente dannosi se il paziente non è fluid responder (l’effetto emodinamico della manovra è autolimitantesi).
Anche le linee guida tedesche sulla terapia intravascolare nell’adulto pubblicate di recente sull’European Journal of Anesthesiology40 riconoscono l’utilità del PLR e ne consigliano l’esecuzione per decidere se somministrare o no un bolo di fluidi.
L’ecocardio63-69 oltre a fornire informazioni mirate all’inquadramento diagnostico dello shock e una visione anche semplicemente occhiometrica della funzione sistolica dei due ventricoli, in mano ad esperti, può essere utilizzata per la valutazione dello SV e della CO e soprattutto delle eventuali variazioni indotte dalle prove dinamiche (fluid challenge, PLR, variazioni legate al ciclo respiratorio in respiro spontaneo o ventilazione meccanica, l’End Expiratoy Occlusion Test). La gittata cardiaca (CO) è pari a SV x FC: lo SV in virtù dell’equazione di continuità, è pari al prodotto fra l’area della sezione trasversa del cono di efflusso del ventricolo sinistro (Π x (LVOT /2)2, misurato in proiezione parasternale asse lungo) e l’integrale velocità tempo del flusso aortico misurato con Doppler pulsato a livello del cono d’efflusso in proiezione apicale 5 camere. Rapportando poi la CO alla superficie cardiaca si ottiene l’indice cardiaco. L’utilizzo dell’ecocardio nell’approccio al paziente in shock è suggerita dalla Consensus dell’ESCIM per la caratterizzazione dello shock, la selezione dell’intervento terapeutico più idoneo e la rivalutazione del paziente dopo ogni provvedimento terapeutico.
L’associazione del PLR alla valutazione ecocardiografica dello SV può essere garanzia di una buona accuratezza: la già citata review di JAMA18 ha evidenziato come in particolare il LR + per fluid responder è pari a 11 mentre il LR – per non fluid responder è pari a 0.13 con valori sovrapponibili nei pazienti ventilati ed in respiro spontaneo.
Bibliografia
- Assessment of intravascular volume status and volume responsiveness in critically ill patients Kambiz Kalantari, Jamison N. Chang, Claudio Ronco and Mitchell H. Rosner. Kidney International (2013) 83,1017–1028.
- Physiological controversies and methods used to determine fluid responsiveness: a qualitative systematic review B. M. Ansari,V. Zochios,F. Falter and A. A. Klein. Anaesthesia 2016,71,94–105.
- Hemodynamic parameters to guide fluid therapy Marik PE, Monnet X, Teboul JL. Ann Crit Care 2011;1:1.
- Starling curves and central venous pressure David A Berlin and Jan Bakker Critical Care (2015)19:55.
- Assessment of volume responsiveness during mechanical ventilation: recent advances Xavier Monnet, Jean-Louis Teboul. Critical Care 2013,17:217.
- A rational approach to fluid therapy in sepsis P. Marik and R. Bellomo British Journal of Anaesthesia, 116(3):339–49 (2016).
- Decreased mortality, morbidity and emergency transport in septic shock: A new protocol based on advanced noninvasive haemodynamics and early antibiotics Smith B, Phillips R, Madigan V,West M. Crit Care Med 2013;40:1–17.
- Mini-fluid challenge in patients with low-volume mechanical ventilation: the decrease in pulse pressure and stroke volume variations accurately predicts fluid responsiveness Mallat J, Meddour M, Durville E, et al. Br J Anaesth 2015;115:449–56.
- Response to fluid boluses in the fluid and catheter treatment trial Lammi MR, Aiello B, Burg GT, et al. Chest Advance Access published on May 28, 2015. doi:10.1378/chest.15-0445.
- A randomized, controlled, double-blind crossover study on the effects of 2-L infusions of 0.9% saline and plasma-lyte 148 on renal blood flow velocity and renal cortical tissue perfusion in healthy volunteers Chowdhury AH, Cox EF, Francis S, Lobo DN. Ann Surg 2012;256:18–24.
- Comparison of fluid compartments and fluid responsiveness in septic and non-septic patients Sanchez M, Jimenez-Lendinez M, Cidoncha M, et al. Anaesth Intensive Care 2011;39:1022–9.
- Plasma volume expansion by 0.9% NaCl during sepsis/systemic inflammatory response syndrome, after hemorrhage, and during a normal state Bark BP, Oberg CM, Grande PO. Shock 2013;40:59–64.
- Is the concept of fluidresponsiveness evidence-based? A.S. Saleh. Intensive Care Medicine, Vol 42, no 7, pp 1187-1188 2016.
- Consensus on circulatory shock and hemodynamic monitoring. Task force of the European Society of Intensive Care Medicine Maurizio Cecconi Daniel De Backer Massimo Antonelli Richard Beale Jan Bakker Christoph Hofer Roman Jaeschke Alexandre Mebazaa Michael R. Pinsky Jean Louis Teboul Jean Louis Vincent Andrew Rhodes. Intensive Care Med November 2014 DOI 10.1007/s00134-014-3525-z.
- Alteration of skin perfusion in mottling area during septic shock Hafid Ait-Oufella, Simon Bourcier, Mikael Alves, Arnaud Galbois, Jean-Luc Baudel, Dimitri Margetis, Naike Bige, Georges Offenstadt, Eric Maury and Bertrand Guidet. Annals of Intensive Care 2013,3:31.
- Toe‑to‑room temperature gradient correlates with tissue perfusion and predicts outcome in selected critically ill patients with severe infections Simon Bourcier, Claire Pichereau, Pierre‑Yves Boelle, Safaa Nemlaghi, Vincent Dubée, Gabriel Lejour,Jean‑Luc Baudel, Arnaud Galbois, Jean‑Remi Lavillegrand, Naïke Bigé, Jalel Tahiri, Guillaume Leblanc,Eric Maury, Bertrand Guidet and Hafid Ait‑ Ann. Intensive Care (2016)6:63.
- Capillary refill time exploration during septic shock Hafid Ait‑Oufella, N.Bige, P.Y.Boelle, C. Pichereau. Intensive Care Medicine (2014)40:958-964.
- Will This Hemodynamically Unstable Patient Respond to a Bolus of Intravenous Fluids? Peter Bentzer, MD, PhD; Donald E. Griesdale, MD, MPH; John Boyd, MD; Kelly MacLean, MD; Demetrios Sirounis, MD; Najib T. Ayas, MD, MPH. 2016;316(12):1298-1309. doi:10.1001/ jama. 2016,12310.
- The reliability of the physical examination to guide fluid therapy in adults with severe falciparum malaria: an observational study Hanson J, Lam SW, Alam S, et al. Malar J. 2013;12:348.
- Prediction of fluid responsiveness in patients admitted to the medical intensive care unit Saugel B, Kirsche SV, Hapfelmeier A, et al. J Crit Care. 2013;28(4):537.e1-537.e9.
- Longitudinal analysis of one million vital signs in patients in an academic medical center Bleyer AJ, Vidya S, Russell GB, et al. 2011;82:1387–92.
- National Early Warning Score (NEWS) Standardising the assessment of acute-illeness severity in the NHS Royal College of Physicians July 2012.
- Basic concepts of fluid responsiveness T. G. V. Cherpanath & B. F. Geerts & W. K. Lagrand & M. J. Schultz & A. B. J. Groeneveld. Neth Heart J (2013)21:530–536.
- What is a fluid challenge? M. Cecconi, A. K. Parsons, and A. Rhodes Current Opinion in Critical Care, vol. 17, no. 3, pp. 290–295, 2011.
- Fluid challenges in intensive care: the FENICE study. A global inception cohort study M. Cecconi, C. Hofer, J.-L. Teboul et al. Intensive Care Medicine, vol. 41,no. 9, pp. 1529–1537, 2015.
- Passive leg raising: five rules, not a drop of fluid! Xavier Monnet and Jean-Louis Teboul Critical Care (2015) 19:18 DOI 10.1186/s13054-014-0708-5.
- Changes in Arterial Pressure during Mechanical Ventilation Frèdèric Michard, M.D., Ph.D. Anesthesiology 2005;103:419–28.
- Predicting volume responsiveness by using the end-expiratory occlusion in mechanically ventilated intensive care unit patients Monnet X, Osman D, Ridel C, Lamia B, Richard C, Teboul JL Crit Care Med 2009,37:951-956.
- Defining the boundaries of preload responsiveness at the bedside Michael R. Pinsky, MD, MCCM Pediatr Crit Care Med. 2015 January;16(1):82–83.
- Advanced Hemodynamic Management in Patients with Septic Shock Bernd Saugel,Wolfgang Huber, Axel Nierhaus, Stefan Kluge,Daniel A. Reuter, and Julia Y. Wagner BioMed Research International Volume 2016, Article ID 8268569.
- Assessment of volume responsiveness during mechanical ventilation: recent advances Xavier Monnet, Jean-Louis Teboul Monnet and Teboul Critical Care 2013,17:217.
- Predicting the determinants of volume responsiveness Xavier Monnet Michael R. Pinsky Intensive Care Med DOI 10.1007/s00134-014-3637-5.
- Physiological controversies and methods used to determine fluid responsiveness: a qualitative systematic review M. Ansari, V. Zochios, F. Falter and A. A. Klein Anaesthesia 2016;71,94–105.
- Hemodynamic parameters to guide fluid therapy Paul E Marik, Xavier Monnet, Jean-Louis Teboul Annals of Intensive Care 2011,1:1.
- Monitoring fluid responsiveness Christoph K. Hofer, Maxime Cannesson Acta Anaesthesiologica Taiwanica 49 (2011) 59e65.
- Applied physiology at the bedside to drive resuscitation algorithms Andre L. Holder, MD, MS and Michael R. Pinsky, MD, CM, Dr hc, FCCP, MCCM J Cardiothorac Vasc Anesth. 2014 December;28(6):1642–1659.
- Monitoring volume and fluid responsiveness: From static to dynamic indicators Laurent Guerin, MD, Assistant a,b,1, Xavier Monnet, MD,PhD, Prof. a,b,2, Jean-Louis Teboul, MD, PhD Best Practice & Research Clinical Anaesthesiology 27 (2013)177–185.
- Functional Hemodynamic Monitoring Michael R. Pinsky, MD, CM, Dr hc, MCCM, FCCP Crit Care Clin. 2015 January ;31(1):89–111 .
- Assessing Volume Status Michael C. Scott, MD, Haney Mallemat, MD Emerg Med Clin N Am 32(2014)811–822.
- Intravascular volume therapy in adults Guidelines from the Association of the Scientific Medical Societies in Germany Gernot Marx, Achim W. Schindler et al Eur J Anaesthesiol 2016;33:1–34.
- Applicability of pulse pressure variation: how many shades of grey? Frederic Michard, Denis Chemla and Jean-Louis Teboul Critical Care (2015)19:144.
- Haemodynamic monitoring using arterial waveform analysis Michelle S. Chewa and Anders A ° neman Curr Opin Crit Care 2013,19:234–241.
- Extravascular lung water in critical care: recent advances and clinical applications Mathieu Jozwiak, Jean‑Louis Teboul and Xavier Monnet Intensive Care (2015)5:38.
- Persistent microcirculatory alterations are associated with organ failure and death in patients with septic shock Yasser Sakr, MB, BCh, MSc; Marc-Jacques Dubois, MD; Daniel De Backer, MD, PhD; Jacques Creteur, MD, PhD; Jean-Louis Vincent, MD, PhD, FCCM Crit Care Med 2004 Vol. 32, No. 9.
- International Study on Microcirculatory Shock Occurrence in Acutely Ill Patients Namkje A. R. Vellinga, MD et al. Critical Care Medicine.
- Microcirculatory Alterations in Patients With Severe Sepsis: Impact of Time of Assessment and Relationship With Outcome Daniel De Backer MD, PhD; Katia Donadello MD; Yasser Sakr MD, PhD; Gustavo Ospina-Tascon MD; Diamantino Salgado MD; Sabino Scolletta MD; Jean-Louis Vincent MD, PhD, FCCM Critical Care Medicine March 2013 • Volume 41 • Number 3.
- How to evaluate the microcirculation: report of a round table conference Daniel De Backer, Steven Hollenberg, Christiaan Boerma, Peter Goedhart, Gustavo Büchele, Gustavo Ospina-Tascon, Iwan Dobbe and Can Ince Critical Care Vol 11 No 5.
- Use of non-invasive NIRS during a vascular occlusion test to assess dynamic tissue O2 saturation response Hernando Go´mez ,Andre´s Torres, Patricio Polanco, Hyung Kook Kim, Sven Zenker,Juan Carlos Puyana,Michael R. Pinsky Intensive Care Med (2008)34:1600–1607.
- The prognostic value of muscle StO2 in septic patients Jacques Creteur, Tiziana Carollo, Giulia Soldati, Gustavo Buchele, Daniel De Backer, Jean-Louis Vincent Intensive Care Med (2007)33:1549–1556.
- Assessment of Postresuscitation volume status by Bioimpedance anallysis in patients with sepsis in the intensive care Unit: a pilot observational study Bram Rochwerg, Jason H Cheung, Christine M. Ribic et al Canadian Respiratory Journal Volume 2016 , article ID 8671742.
- Assessment of the plethysmographic variability index as a predictor of fluid responsiveness in critically ill patients: a pilot study K. Baker, R. J. O. Partrid ge, E. Litton, K. M. Ho Anaesth Intensive Care 2013;41:736-741.
- Volume Responsiveness in Critically Ill Patients Use of Sonography to Guide Management David Evans, MD, Giovanna Ferraioli, MD, John Snellings, MD, Alexander Levitov, MD J Ultrasound Med 2014;33:37|0278-4297.
- Effect of Bedside Ultrasonography on the Certainty of Physician Clinical Decisionmaking for Septic Patients in the Emergency Department Samir A. Haydar, DO, MPH, Eric T. Moore, MD, George L. Higgins, III, MD, Christine B. Irish, MD, William B. Owens, MD,Tania D. Strout, PhD, RN, MS Annals of Emergency Medicine Volume 60 NO 3: September 2012.
- Respiratory changes in inferior vena cava diameter are helpful in predicting fluid responsiveness in ventilated septic patients Christophe Barbier Yann Loubires Christophe Schmit Jan Hayon Jean-Louis Ricame Francois Jardin Antoine Vieillard-Baron Intensive Care Med (2004)30:1740–1746.
- The respiratory variation in inferior vena cava diameter as a guide to fluid therapy Marc Feissel, Fredric Michard, Jean-Pierre Faller,Jean-Louis Teboul Intensive Care Med (2004)30:1834–183.
- Respiratory variation in inferior vena cava diameter: surrogate of central venous pressure or parameter of fl uid responsiveness? Let the physiology reply Laurent Bodson and Antoine Vieillard-Baron Critical Care 2012,16:181.
- Does inferior vena cava respiratory variability predict fluid responsiveness in spontaneously breathing patients? Norair Airapetian, Julien Maizel, Ola Alyamani, Yazine Mahjoub, Emmanuel Lorne, Melanie Levrard,Nacim Ammenouche, Aziz Seydi, François Tinturier, Eric Lobjoie, Hervé Dupont and Michel Slama Critical Care (2015)19:400.
- Respiratory variations of inferior vena cava diameter to predict fluid responsiveness in spontaneously breathing patients with acute circulatory failure: need for a cautious use Laurent Muller, Xavier Bobbia, Mehdi Toumi, Guillaume Louart, Nicolas Molinari, Benoit Ragonnet, Hervé Quintard, Marc Leone, Lana Zoric, Jean Yves Lefrant and the AzuRea group Critical Care 2012,16:R188.
- Emergency Department Bedside Ultrasonographic Measurement of the Caval Index for Noninvasive Determination of Low Central Venous Pressure Arun D. Nagdev, MD Roland C. Merchant, MD, MPH,ScD Alfredo Tirado-Gonzalez, MD Craig A. Sisson, MD Michael C. Murphy, MD Annals of Emergency MedicineVolume 55 NO. 3: March 2010.
- Superior vena caval collapsibility as a gauge of volume status in ventilated septic patients Antoine Vieillard-Baron,Karim Chergui,Anne Rabiller,Olivier Peyrouset,Bernard Page,Alain Beauchet,Francois Jardin Intensive Care Med (2004)30:1734–1739.
- Jugular vein distensibility predicts fluid responsiveness in septic patients Fabio Guarracino, Baldassarre Ferro, Francesco Forfori, Pietro Bertini, Luana Magliacano and Michael R Pinsky Critical Care (2014)18:647.
- International evidence-based recommendations for point-of-care lung ultrasound Giovanni Volpicelli, Mahmoud Elbarbary,Michael Blaivas IntensiveCareMedDOI 10.1007/s00134-012-2513-4.
- Echocardiographic measurement of fluid responsiveness Cyril Charron, Vincent Caille, Francois Jardin and Antoine Vieillard-Baron Curr Opin Crit Care 12:249–254.
- Echocardiography as a guide for fluid management John H. Boyd, Demetrios Sirounis, Julien Maizel and Michel Slama Critical Care (2016)20:274.
- Predicting and measuring fluid responsiveness with echocardiography A Miller and J Mandeville Echoresaerch and practice ID:16-0008; June 2016 DOI:10.1530/ERP-16-0008.
- Cardiac Output Assessed by Invasive and Minimally Invasive Techniques Allison J. Lee, Jennifer Hochman Cohn, and J. Sudharma Ranasinghe Anesthesiology Research and Practice Volume2011,ArticleID475151,17.
- Current tools for assessing heart function and perfusion adequacy Sheldon Magder Curr Opin CritCare2014,20:294–300.
- Transesophageal ecocardiography: what the anestesiologist has to know Massimiliano Meineri,MinervaAnestesiologica2016August 82(8):895-907.
- An Increase in Aortic Blood Flow after an Infusion of 100 ml Colloid over 1 Minute Can Predict Fluid Responsiveness The Mini-fluid Challenge Study Laurent Muller, M.D., M.Sc., Medhi Toumi, M.D.,Philippe-Jean Bousquet, M.D., Be´ atrice Riu-Poulenc, M.D., Guillaume Louart, M.D., Damien Candela, M.D., Lana Zoric, M.D., Carey Suehs, Ph.D., Jean-Emmanuel de La Coussaye, M.D., Ph.D., Nicolas Molinari, Ph.D., Jean-Yves Lefrant, M.D., Ph.D., in the AzuRe´ a Group Anesthesiology 2011;115:541–7.
- A systematic review of goal directed fluid therapy: Rating of evidence for goals and monitoring methods Heath Wilms, BCom, MBus, Anubhav Mittal, BHB, MBChB, PhD, FRACS, Matthew D. Haydock, Marc van den Heever, BCA, BSc, Marcello Devaud, MBChB, John A. Windsor, BSc, MBChB, MD, FRACS, FACS Journal of Critical Care.
- Volume responsive, but does the patient need volume Jukka Takala Intensive Care Medicine (2016)42:1461-1463.
- Clinical monitoring of peripheral perfusion: there is more to learn Alexandre Lima and Jan Bakker, CriticalCare2014,18:113.
- Towards integrative physiological monitoring of the critically ill: from cardiovascular to microcirculatory and cellular function monitoring at the bedside Abele Donati, Dick Tibboel and C.Ince,CriticalCare2013,17(Suppl1):S5.
- Efficacy of an extravascular lung water-driven negative fluid balance protocol L. Díaz-Rubia, S. Ramos-Sáez, R. Vázquez-Guillamet, F. Guerrero-López,F. Pino-Sánchez, M. García-Delgado, F.J. Gómez-Jiménez, E. Fernández-Mondéjar Med Intensiva. 2015;39(6):345—351.
- Extravascular lung water monitoring of renal replacement therapy in lung water scavenging for septic acute kidney injury Han Liu, Ying Liu, Jia-Kui Sun, Qiao-Lian Xu, Ying Yan, Yong-Ming Chen, Liang Hong, Huan Xu Int J Clin Exp Med 2015;8(10):18907-18916.
- Early-phase changes of extravascular lung water index as a prognostic indicator in acute respiratory distress syndrome patients Takashi Tagami, Toshiaki Nakamura, Shigeki Kushimoto, Ryoichi Tosa, Akihiro Watanabe, Tadashi Kaneko,Hidetada Fukushima, Hiroshi Rinka, Daisuke Kudo, Hideaki Uzu, Akira Murai, Makoto Takatori, Hiroo Izumino, Yoichi Kase, Ryutarou Seo, Hiroyuki Takahashi, Yasuhide Kitazawa, Junko Yamaguchi, Manabu Sugita, Hiroyuki Takahashi, Yuichi Kuroki, Takashi Kanemura, Kenichiro Morisawa,Nobuyuki Saito, Takayuki Irahara and H. Yokota,AnnalsofIntensiveCare2014,4:27.
- Extravascular lung water is an independent prognostic factor in patients with acute respiratory distress syndrome Mathieu Jozwiak, MD; Serena Silva, MD; Romain Persichini, MD; Nadia Anguel, MD; David Osman, MD Christian Richard, MD; Jean-Louis Teboul, MD, PhD; Xavier Monnet, MD, PhD Critical Care Medicine February 2013 • Volume 41 • Number 2.
- Fluid overload, de-resuscitation, and outcomes in critically ill or injured patients: a systematic review with suggestions for clinical practice Manu L.N.G. Malbrain, Paul E. Marik, Ine Witters, Colin Cordemans, Andrew W. Kirkpatrick,Derek J. Roberts,Niels Van Regenmortel Anaesthesiology IntensiveTherapy2014,vol.46,no5,361–380.
- Iatrogenic salt water drowning and the hazards of a high central venous pressure Paul E Marik,AnnalsofIntensiveCare2014,4:21.
- Do not drown the patient: appropriate fluidmanagement in critical illness Kees H. Polderman, MD, PhD, Joseph Varon, MD American Journal of Emergency Medicine 33 (2015)448–450.
- Whole body ultrasonography in the Critical ill Lichtenstein DA 2010.
- Ultrasound of extravascular lung water: a new standard for pulmonary congestion Eugenio Picano and Patricia A. Pellikka European Heart Journal doi:10.1093/eurheartj/ehw164.
- Lung water assessment by lung ultrasonography in intensive care: a pilot study Giacomo Baldi Luna Gargani,Antonio Abramo,Luigia D’Errico,Davide Caramella,Eugenio Picano,Francesco Giunta, F.Forfori,IntensiveCareMed(2013)39:74–84.
- Clinical review: the role of ultrasound in estimating extra vascular lung water Murali Shyamsundar,et.al,CriticalCare2013,17:237.
- Simplified lung ultrasound protocol shows excellent prediction of extravascular lung water in ventilated intensive care patients Philipp Enghard, Sibylle Rademacher, Jens Nee, Dietrich Hasper, Ulrike Engert, Achim Jörres and Jan M Kruse Critical Care (2015)19:36.
- Ultrasound assessment of antibiotic-induced pulmonary reaeration in ventilator-associated pneumonia Be´ laïd Bouhemad, MD, PhD; Zhi-Hai Liu, MD; Charlotte Arbelot, MD; Mao Zhang, MD; Fabio Ferarri, MD, PhD; Morgan Le-Guen, MD; Martin Girard, MD; Qin Lu, MD, PhD; Jean-Jacques Rouby, MD, PhD Crit Care Med 2010 Vol. 38, No.1 .
- Assessment of oxygenation response to prone position ventilation in ARDS by lung ultrasonography Claude Guerin and Luciano Gattinoni Intensive Care Med DOI 10.1007/s00134-016-4440-2.
- Bedside Ultrasound Assessment of Positive End-Expiratory Pressure–induced Lung Recruitment Belaı¨d Bouhemad, He´le`ne Brisson, Morgan Le-Guen, Charlotte Arbelot, Qin Lu, and Jean-Jacques Rouby American Journal of Respiratory and Critical Care Medicine vol 183 2011.
- Lung sonography and recruitment in patients with early acute respiratory distress syndrome: a pilot study Konstantinos Stefanidis, Stavros Dimopoulos, Elli-Sophia Tripodaki, Konstantinos Vitzilaios, Panagiotis Politis, Ploutarchos Piperopoulos and Serafim Nanas Stefanidis et al. Critical Care2011,15:R185.
- Ultrasound assessment of lung aeration loss during a successful weaning trial predicts postextubation distress Alexis Soummer, MD; Sébastien Perbet, MD; Hélène Brisson, MD; Charlotte Arbelot, MD; Jean-Michel Constantin, MD, PhD; Qin Lu, MD, PhD; Jean-Jacques Rouby, MD, PhD; and the Lung Ultrasound Study Group Crit Care Med 2012 Vol. 40, No. 7 .
- Early lung ultrasonography predicts the occurrence of acute respiratory distress syndrome in blunt trauma patients Damien Leblanc, Cle´ment Bouvet, Franck Degiovanni, Cosmina Nedelcu, Guillaume Bouhours, Emmanuel Rineau,Catherine Ridereau-Zins, Laurent Beydon,Sigismond Lasocki,IntensiveCareMed,DOI10.1007/s00134-014-3382-9.
- Lung ultrasound in the ICU: from diagnostic instrument to respiratory monitoring tool Via, E. Storti , G. Gulati , l. Neri, F. Mojoli , A. Braschi Minerva anestesiologica vol. 78 – no.11.
- FALLS-protocol: lung ultrasound in hemodynamic assessment of shock D. Lichtenstein Heart,LungandVessels.2013;5(3):142-147.
- Development of a fluid resuscitation protocol using inferior vena cava and lung ultrasound C. Lee, MD, BASc, Pierre D. Kory, MPA, MD, Robert T. Arntfield, MD, FRCPC Journal of Critical Care 31 (2016)96–100.