- Savino Russo e Paolo Onorato
- Original Article
La protezione del microcircolo: scelta ragionata di liquidi e farmaci vasoattivi nella prima fase di gestione della Sepsi
- 3/2017-Ottobre Supplemento
- ISSN 2532-1285
- https://doi.org/10.23832/ITJEM.2017.031
S. Russo e P. Onorato
Background
Lo shock settico è una condizione in cui, a causa di una risposta infiammatoria a microorganismi, il circolo diventa incapace di rilasciare ossigeno sufficiente alle richieste tissutali1.
Storicamente l’enfasi è stata posta su ridotti valori della pressione arteriosa (PA)2 nel contesto di un processo infettivo. Le acquisizioni più recenti hanno spostato l’attenzione sul microcircolo, vero motore della sepsi e dello shock settico3-6: queste condizioni oggi possono essere definite in maniera più appropriata come malattia acuta del microcircolo7. In questa nuova prospettiva obiettivo della gestione emodinamica non è più l’ottimizzazione della pressione arteriosa, bensì la preservazione del microcircolo, sistema funzionale8 da “rianimare”9,10.
Dalla macrodinamica alla microdinamica
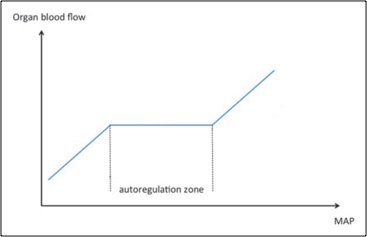
All’interno di un range di valori di pressione arteriosa media il flusso ematico che perfonde un organo rimane costante, e questo range viene definito “zona di autoregolazione”. Se la pressione media si abbassa sotto al valore minimo del range corrispondente alla zona di autoregolazione il flusso diminuisce e diventa dipendente dalla pressione di perfusione11. In corso di sepsi l’autoregolazione tende a perdersi12,13. Questo principio condiziona le strategie di preservazione della pressione arteriosa media e di portata cardiaca, che in corso di shock settico sono frequentemente ridotte.
Figura 1. Nella zona di autoregolazione il flusso ematico che perfonde i tessuti è indipendente dai valori di PAM. La perdita dell’autoregolazione fa sì che il flusso ematico diventi dipendente dalla PAM. Adattato da Beloncle11
La variazione della pressione arteriosa si associa con relazione diretta alle variazioni della portata cardiaca e delle resistenze vascolari14; la portata cardiaca a sua volta dipende in maniera diretta dal ritorno venoso, secondo curve di correlazione che indicano un livello oltre il quale un ulteriore aumento del ritorno venoso non causa ulteriore incremento della portata cardiaca15, dalla contrattilità miocardica e dalla frequenza cardiaca.
Questo semplice modello costituisce la base dei comuni schemi di gestione dello shock: liquidi per aumentare il ritorno venoso e quindi la portata cardiaca; vasopressori per incrementare la pressione arteriosa e quindi preservare la zona di autoregolazione; dobutamina per migliorare la contrattilità e quindi la portata cardiaca. In presenza di un’adeguata capacità di trasporto di O2, che eventuali trasfusioni di eritrociti contribuiscono ad assicurare16, il rilascio di O2 ai tessuti aumenta17. Ciò dovrebbe condurre ad un miglioramento della perfusione tissutale ed, in ultima analisi, ad aumento della sopravvivenza.
Né l’incremento della pressione arteriosa tuttavia18 né l’aumento della portata cardiaca19 determinano un maggior numero di capillari perfusi e l’aumento del ritorno venoso (monitorato con pressione venosa centrale) è associato a riduzione del flusso nel microcircolo20.
In realtà l’accoppiamento emodinamico, ovvero la relazione tra parametri macroemodinamici (PA, portata cardiaca e parametri derivati quali trasporto e rilascio di O2) e funzione microdinamica (perfusione capillare, densità capillare, funzione endoteliale) nello shock settico è molto labile21 e può giungere fino ad un disaccoppiamento totale22.
Pertanto, se è inevitabile una gestione basata su macroparametri, risulta fondamentale cambiare target23: l’obiettivo non è tanto il semplice aumento della PA o il “riempimento” indiscriminato, quanto l’ottimizzazione del microcircolo e l’evitare la disfunzione microcircolatoria iatrogena, ottenuti attraverso la migliore conoscenza e l’accorto utilizzo dei presidi terapeutici più frequentemente utilizzati: liquidi, vasopressori, inotropi.
I liquidi
Benché frequentemente concepiti come semplice volume utile ad aumentare la pressione arteriosa, i liquidi hanno le caratteristiche di un farmaco24,25, e come tutti i farmaci vanno utilizzati in maniera corretta per evitare complicanze.
L’indicazione più importante all’utilizzo dei liquidi è il miglioramento della perfusione tissutale26, la quale dipende dalla quantità27 e dal tipo28,29 di liquido utilizzato.
Come tutti i farmaci i liquidi hanno proprietà farmacodinamiche30 e una farmacocinetica peculiare31, di tipo multicompartimentale e caratterizzata da una lenta cinetica di eliminazione. A causa della redistribuzione nei vari compartimenti, il bolo di 500 ml di cristalloide cambia la risposta macroemodinamica (pressione arteriosa media, frequenza cardiaca, portata cardiaca) per un tempo limitato a circa un’ora32; una quantità equivalente di albumina ha un effetto leggermente più prolungato ma comunque limitato nel tempo33.
Queste caratteristiche sono responsabili dell’effetto transitorio dei boli di liquidi sui parametri macroemodinamici e sulla formazione di edema periferico che a volte richiede dialisi e che lascia a lungo il microcircolo disfunzionante34.
I liquidi appartengono a tre classi distinte: albumina, colloidi e cristalloidi.
L’albumina è stata estesamente studiata35-37, ma manca ancora la dimostrazione di un reale beneficio nello shock settico38.
I colloidi sono i destrani, le gelatine (Gelofusine, Emagel) e i derivati dell’amido (Voluven). Tutti i colloidi aumentano il rischio di insufficienza renale acuta e di dialisi e sono associati ad aumento della mortalità39-41, pertanto probabilmente non bisognerebbe più utilizzarli42.
E’ preferibile quindi utilizzare i cristalloidi.
I cristalloidi a disposizione possono essere sia bilanciati, contenenti cioè bicarbonato in forma di acido debole (acetato in Ringer Acetato o lattato in Ringer Lattato e Reidratante III), sia non bilanciati (unico esempio ne è la “soluzione fisiologica”).
La Soluzione Fisiologica in realtà non ha nulla di fisiologico in quanto ha una concentrazione di NaCl superiore a quella plasmatica. L’ipercloremia dovuta a questo cristalloide causa riduzione della perfusione capillare43, aumenta il rischio di insufficienza renale acuta23 e la mortalità, indipendentemente dal volume somministrato44.
Globalmente quindi sembra che l’outcome migliore sia ottenuto con cristalloidi bilanciati45, anche se su grossi numeri le differenze tra i vari cristalloidi potrebbero ridursi46. La quantità di cristalloidi da somministrare è cruciale per la preservazione del microcircolo. Infatti in caso di ipervolemia il glicocalice capillare va incontro a sfaldamento47,48 con conseguente peggioramento della disfunzione endoteliale ed aumento dell’edema, cause di ipossia cellulare21 e peggioramento del disaccoppiamento macro-micro49.
La quantità di liquidi somministrati condiziona allungamento dei tempi di degenza50, insufficienza renale acuta51, mortalità53. Per contro, in pazienti settici il bilancio idrico negativo precoce si associa a miglioramento della prognosi52.
Pertanto un atteggiamento volto alla preservazione del microcircolo contempla la somministrazione di volumi non elevati di cristalloidi bilanciati.
I suggerimenti che provengono da vari studi prevedono l’utilizzo di cristalloidi somministrati in boli di modesta entità, come 20-25 ml/Kg nell’arco di sei ore, e l’uso precoce di noradrenalina54.
I vasopressori
Il raggiungimento di valori pressori che preservino la zona di autoregolazione è solitamente uno dei principali obiettivi perseguiti nel corso della gestione dello shock settico: dopo il bolo di liquidi, il secondo step consiste nell’infusione di vasopressori.
Le catecolamine più frequentemente utilizzate in questo contesto sono dopamina e noradrenalina.
Tra queste due amine la seconda è quella maggiormente usata e raccomandata55 come prima linea, in quanto gravata da minori effetti collaterali rispetto alla dopamina58.
La noradrenalina aumenta la pressione non solo inducendo vasocostrizione (questo potrebbe essere considerato un effetto collaterale quando molto importante59) ma anche perché aumenta il precarico per reclutamento dello stressed volume60-62.
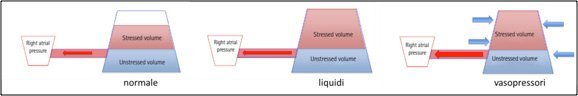
La volemia può essere definita in vari modi: dal punto di vista anatomico il volume ematico si ripartisce nel circolo sistemico (83% circa), nel circolo polmonare (9%) e nel cuore in diastole (8%); dal punto di vista emodinamico si distinguono due circuiti in serie, uno a bassa pressione ed elevata compliance (settore venoso capacitivo, 88% della volemia) ed uno ad alta pressione e bassa compliance (settore arterioso resistivo, 12% della volemia); dal punto di vista funzionale si considerano il volume che serve alla semplice messa in tensione statica del sistema venoso (unstressed volume, circa il 70% della volemia) ed il volume da cui dipende il gradiente di forza motrice intravascolare e che contribuisce alle relazioni circolatorie dinamiche (stressed volume, circa il 30% della volemia)77. La noradrenalina induce venocostrizione nel territorio splancnico, riduce la compliance venosa ed aumenta quindi lo stressed volume78: a parità di liquidi infusi, con noradrenalina il precarico risulta aumentato ed è ridotto il rischio di sovraccarico del sistema venoso.
Figura 2. L’infusione di liquidi aumenta il ritorno venoso, e quindi la pressione atriale, a causa dell’aumento dello stressed volume. La noradrenalina aumenta il ritorno venoso attraverso un’azione di “spremitura” del sistema venoso e reclutamento dello stressed volume, con volemia totale immodificata: questo è il razionale della noradrenalina precoce nello shock settico.Adattato da Spiegel61
La noradrenalina inoltre ha un’azione sul flusso microvascolare in quanto normalizza la velocità degli eritrociti nei capillari63.
Poiché in corso di sepsi la zona di autoregolazione viene persa, o comunque si modifica rispetto al soggetto sano15, non è chiaro quale sia il livello ottimale di pressione da raggiungere.
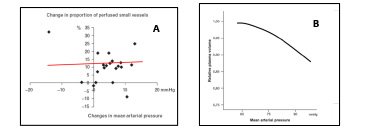
Vari studi sono stati effettuati per confrontare livelli diversi di pressione arteriosa media. Da questi studi emerge che livelli più elevati di pressione media non sono associati a miglioramento della prognosi46 né del metabolismo cellulare47.
Figura 3. L’aumento della pressione arteriosa non migliora la perfusione18 (A) ma causa anzi un peggioramento dell’edema, dimostrato dalla riduzione del volume plasmatico che si osserva con valori pressori elevati64 (B)
I livelli ottimali di pressione arteriosa media, associati a miglioramento della prognosi sono di 60-65 mmHg46, e sembra inutile se non dannoso11,64, raggiungere valori più elevati. La somministrazione precoce di noradrenalina sembra associarsi ad un outcome migliore65,66.
Pertanto, ai fini della protezione del microcircolo, potrebbe risultare efficace l’infusione di basse dosi di noradrenalina, avviata precocemente senza attendere il pieno “riempimento”, mirando a valori non elevati di PA media.
La dobutamina
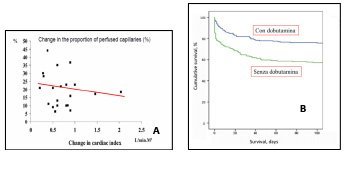
In una recente metanalisi concernente lo scompenso cardiaco è emerso che la dobutamina non ha ridotto la mortalità nei pazienti a cui era stata somministrata rispetto al gruppo di controllo67; nello shock settico l’uso di questa amina pare gravato da aumento della mortalità68.
Figura 4. Pur aumentando la portata cardiaca, la dobutamina si associa a riduzione della perfusione19 (A) ed aumento della mortalità68 (B)
Probabilmente il suo utilizzo dovrebbe essere riservato a casi ben selezionati e con possibilità di monitoraggio sia degli endpoints sia degli effetti collaterali.
Nuove prospettive
Numerosi studi sono in corso per capire la reale efficacia dei trattamenti effettuati e per esplorare nuove forme di terapia.
Limitando lo sguardo ai trattamenti eventualmente possibili nelle prime ore di gestione dello shock settico, bisogna annoverare i trials che confrontano noradrenalina e vasopressina o terlipressina69,70, e levosimendan verso dobutamina71 o verso noradrenalina72.
Alcuni studi embrionali hanno valutato la possibilità di utilizzare la nitroglicerina in infusione continua associata alla noradrenalina73,74, mentre risultati più promettenti sembrano venire dall’utilizzo di betabloccanti in infusione continua75,76.
Conclusioni
Lo shock settico è una condizione clinica grave a patogenesi complessa. Lungi dall’essere solo infezione associata ad ipotensione arteriosa da normalizzare, essa esige il ragionato utilizzo dei presidi terapeutici a disposizione al fine di preservare un microcircolo disfunzionante.
Il microcircolo viene protetto con quantità non elevate di cristalloidi e con l’infusione precoce di basse dosi di noradrenalina, tali da mantenere la pressione arteriosa media a 60-65 mmHg.
La scelta consapevole e ragionata dei presidi a disposizione e l’abbandono di un comportamento standardizzato sono le chiavi di un trattamento che assicuri il miglior outcome.
Bibliografia
- Cecconi M, et al. Consensus on circulatory shock and hemodynamic monitoring. Task force of the European Society of Intensive Care Medicine. Intensive Care Med 2014.
- Abraham E. New Definitions for sepsis and septic shock. Continuing evolution but with much still to be done. JAMA 2016;315(8):757-759.
- Ince C. The microcirculation is the motor of sepsis. Crit Care 2005, 9(suppl 4):S13-S19.
- Burke-Gaffney A, Evans TW. Lest we forget the endothelial glycocalyx in sepsis. Crit Care 2012,16:121.
- Crouser ED. Sepsis-induced endoplasmic reticulum stress: a matter of life and death? Crit Care Med 2016;44(8):1626-1627.
- De Backer D, Orbegozo Cortes D, et al. Pathophysiology of microcirculatory dysfunction and the pathogenesis of septic shock. Virulence 2014;5:1,73–79.
- Spronk PE, et al. Bench-to-bedside review: Sepsis is a disease of the microcirculation. Crit Care 2004,8:462-468.
- Ellis CG, et al. The microcirculation as a functional system. Crit Care 2005, 9(suppl 4):S3-S8.
- Trzeciak, S. et al. Resuscitating the microcirculation in sepsis: the central role of nitric oxide, emerging concepts for novel therapies, and challenges for clinical trials. Critical Care 2005, 9(suppl 4):S3-S8.
- Donati A, Domizi R, et al. From macrohemodynamic to the microcirculation. Critical Care Research and Practice Volume 2013, Article ID 892710.
- Beloncle F, et al. Mean arterial pressure target in patients with septic shock. Minerva Anestesiologica 2016 July;82(7):777-84.
- Prowle JR, et al. Measurement of renal blood flow by phase-contrast magnetic resonance imaging during septic acute kidney injury: a pilot investigation. Crit Care Med 2012;40:1768-76.
- Bateman RM et al. Sepsis impairs microvascular autoregulation and delays capillary response within hypoxic capillaries. Critical Care 2015;19:389.
- Guyton, AC. Overview of the circulation; medical physics of pressure, flow, and resistancetextbook of medical physiology Chapter 14. Guyton, Arthur C / Arthur C. Guyton, John E. Hall.—11th ed. 2006.
- Guyton, AC. Cardiac Output, venous return, and their regulation, Chapter 20. Guyton, Arthur C / Arthur C. Guyton, John E. Hall.—11th ed. 2006.
- Perner A, Smith AS, et al. Red blood cell transfusion during septic shock in the ICU. Acta Anaesthesiol Scand 2012;56:718–723.
- Rivers EP, Yataco AC, et al. Oxygen extraction and perfusion markers in severe sepsis and septic shock: diagnostic, therapeutic and outcome implications. Curr Opin Crit Care 2015,21:381–387.
- Buchele GL, et al. Effects of hydrocortisone on microcirculatory alterations in patients with septic shock. Crit Care Med 2009;37:1341–1347.
- De Backer D, et al. The effects of dobutamine on microcirculatory alterations in patients with septic shock are independent of its systemic effects. Crit Care Med 2006;34:403–408.
- Vellinga NAR et al. Elevated central venous pressure is associated with impairment of microcirculatory blood flow in sepsis: a hypothesis generating post hoc analysis BMC Anesthesiology 2013,13:17.
- De Backer D. Coupling microcirculation to systemic hemodynamics. Curr Opin Crit Care 2010,16:250-254.
- Dyson A, et al. Microvascular and macrovascular flow are uncoupled in early polymicrobial sepsis. BJA 2012;108(6):973–78.
- Harrois A. et al. Targeting the microcirculation in resuscitation of acutely unwell patients. Curr Opin Crit Care 2011,17:303–307.
- Raghunathan K, et al. Fluids are drugs: type, dose and toxicity. Curr Opin Crit Care 2013,19:290–298.
- Hoste EA, et al. Four phases of intravenous fluid therapy: a conceptual model. BJA 2014;113(5):740–7.
- Cecconi M, et al. Fluid challenges in intensive care: the FENICE study. Intensive Care Med 2015;41:1529-1537.
- Ince C. The rationale for microcirculatory guided fluid therapy- Curr Opin Crit Care 2014,20:301–308.
- Raghunathan K, et al. Association between the choice of IV crystalloid and in-hospital mortality among critically ill adults with sepsis. Crit Care Med 2014;42:1585–1591.
- Yunos NM, et al. Chloride-liberal vs. chloride-restrictive intravenous fluid administration and acute kidney injury: an extended analysis. Intensive Care Med (2015)41:257–264.
- Aya HD, Ster IC, et al. Pharmacodynamic analysis of a fluid challenge. Crit Care Med 2016;44:880–891.
- Hahn RG. Volume kinetics for infusion fluids. Anesthesiology. 2010 Aug;113(2):470-81.
- Nunes TSO Duration of hemodynamic effects of crystalloids in patients with circulatory shock after initial resuscitation. Ann Intensive Care 2014,4:25.
- Annane D, et al. Effects of fluid resuscitation with colloids vs crystalloids on mortality in critically ill patients presenting with hypovolemic shock: the CRISTAL randomized trial. JAMA 2013;310:1809–1817.
- Moore JPR, Dyson A, et al. Microcirculatory dysfunction and resuscitation: why, when, and how. BJA 2015,366–75.
- The SAFE Study Investigators. A comparison of albumin and saline for fluid resuscitation in the Intensive Care Unit. N Engl J Med 2004;350:2247-56.
- Caironi P, et al. Albumin replacement in patients with severe sepsis or Septic shock. N Engl J Med 2014;370:1412-21.
- Jiang L, et al. Albumin versus other fluids for fluid resuscitation in patients with sepsis: A meta-analysis. PLOS ONE | DOI:10.1371 December 4, 2014.
- Caironi P, et al. Albumin in critically ill patients: the ideal colloid? Curr Opin Crit Care 2015,21:302–308.
- Mutter TC, et al. Hydroxyethyl starch versus other fluid therapies. Cochrane 2013. Issue 7, Art. No CD007594.
- Perel P – Colloids versus crystalloids for fluid resuscitation in critically ill patients. Cochrane 2013. Issue 2, Art. No CD000567.
- Myburgh JA, et al. Hydroxyethyl starch or saline for fluid resuscitation in intensive care. N Engl J Med 2012;367:1901-11.
- Myburgh JA. Fluid resuscitation in acute medicine: what is the current situation? J Intern Med 2015;277:58–68.
- Abeed H C, et al. A randomized, controlled, double-blind crossover study on the effects of 2-L Infusions of 0.9% saline and plasma-lyte® 148 on renal blood flow velocity and renal cortical tissue perfusion in healthy volunteers. Ann Surgery 2012;256(1):18–24.
- Shaw AD, et al. Association between intravenous chloride load during resuscitation and in-hospital mortality among patients with SIRS. Int Care Med 2014;40:1897-1905.
- Raghunathan K, et al. What is the ideal crystalloid? Curr Opin Crit Care 2015,21:309–314.
- Reddy S, et al. Crystalloid fluid therapy – Crit Care 2016;20:59.
- Chappell et al. Hypervolemia increases release of atrial natriuretic peptide and shedding of the endothelial glycocalyx. Critical Care 2014;18:538.
- Li L, Bonventre JV. Endothelial glycocalyx: not just a sugar coat. Am J Respir Crit Care Med 2016;194(4):390-391.
- Ince C. et al. Why and when the microcirculation becomes disassociated from the macrocirculation. Intensive Care Med 2016;DOI 10.1007/s00134-016-4494-1.
- Aga Z, et al. Greater intravenous fluid volumes are associated with prolonged recovery after colorectal surgery: a retrospective cohort study. BJA 2016;116(6):804–10.
- Payen D. A positive fluid balance is associated with a worse outcome in patients with acute renal failure. Critical Care 2008,12:R74.
- Acheampong A, et al. Early negative fluid balance is independently associated with improved survival in septic patients. Am J Respir Crit Care Med 2014;189:A5496.
- Maitland K, et al. Mortality after fluid bolus in african children with severe infection. N Engl J Med 2011;364:2483-95.
- Hilton AK, et al. A critique of fluid bolus resuscitation in severe sepsisand Bellomo. Crit Care 2012,16:302.
- Moeller MH. Scandinavian SSAI clinical practice guideline on choice of first-line vasopressor for patients with acute circulatory failure. Acta Anaesthesiol Scand 2016;60:1347–1366.
- Asfar P, et al. High versus low blood-pressure target in patients with septic shock. N Engl J Med 2014;370:1583-93.
- Bourgoin A, et al. Increasing mean arterial pressure in patients with septic shock: Effects on oxygen variables and renal function. Crit Care Med 2005;33:780 –786.
- De Backer D, et al. Comparison of dopamine and norepinephrine in the treatment of shock. N Engl J Med 2010;362:779-89.
- Andreis DT. Catecholamines for inflammatory shock: a Jekyll‑and‑Hyde conundrum. Intensive Care Med 2016;42:1387–1397.
- Monnet X, et al. Norepinephrine increases cardiac preload and reduces preload dependency assessed by passive leg raising in septic shock patients. Care Med 2011;39:689–694.
- Spiegel R. Stressed vs. unstressed volume and its relevance to critical care practitioners. Clin Exp Emerg Med 2016;3(1):52-54.
- Funk DJ, Jacobsohn E, et al. The role of venous return in critical illness and shock—Part I: Physiology. Crit Care Med 2013;41:255–262.
- Burban M, et al. Renal macro- and microcirculation autoregulatory capacity during early sepsis and norepinephrine infusion in rats. Critical Care 2013,17:R139.
- Nygren A, et al. Norepinephrine causes a pressure-dependent plasma volume decrease in clinical vasodilatory shock. Acta Anaesthesiol Scand 2010;54: 814–820.
- Bai X, et al. Early versus delayed administration of norepinephrine in patients with septic shock. Critical Care 2014,18:532.
- Hamzaoui O, Georger J-F, et al. Early administration of norepinephrine increases cardiac preload and cardiac output in septic patients with life-threatening hypotension. Crit Care 2010, 14:R142.
- Tacon CL, et al. Dobutamine for patients with severe heart failure: a systematic review and meta-analysis of randomised controlled trials. Intensive Care Med 2012;38:359–367.
- Wilkman E, et al. Association between inotrope treatment and 90-day mortality in patients with septic shock. Acta Anaesthesiol Scand 2013;57:431–442.
- O’Callaghan DJP, et al. What’s new in vasopressin? Intensive Care Med (2015)41:2177–2179.
- Morelli A, et al. Short-term effects of terlipressin bolus infusion on sublingual microcirculatory blood flow during septic shock. Intensive Care Med (2011)37:963–969.
- Morelli A, et al. Levosimendan for resuscitating the microcirculation in patients with septic shock: a randomized controlled study. Critical Care 2010,14:R232.
- Fries M, et al. Levosimendan but not norepinephrine improves microvascular oxygenation during experimental septic shock. Crit Care Med 2008;36:1886 –1891.
- Spronk PE. Nitroglycerin in septic shock after intravascular volume resuscitation. Lancet 2002;360:1395–96.
- Lima A, et al. Nitroglycerin reverts clinical manifestations of poor peripheral perfusion in patients with circulatory shock. Critical Care 2014,18:R126.
- Morelli A, et al. Microvascular effects of heart rate control with esmolol in patients with septic shock: a pilot study. Crit Care Med 2013;41:2162–2168.
- Christensen S, et al. Preadmission beta-blocker use and 30-day mortality among patients in intensive care: a cohort study Critical Care, 2011;15,no. 2.
- Chemla D. Contrȏle circulatoire normal et pathologique. In: Richard C, Teboul J-L, Vincent J-L. Insuffisance circulatoire aiguȅ. 2009 Elsevier Masson SAS.
- Funk DJ, Jacobsohn E, et al. The role of venous return in critical illness and shock—Part I: Physiology. Crit Care Med 2013;41:255–262.