- Isabella Di Zio, Sossio Serra, Federica Stella, Mauro Fallani
- Sulle tracce dell'ECG
Sulle tracce dell’ECG: STEMI
- 5 - Novembre 2013
- ISSN 2532-1285
Case Report
Siamo in un Punto di Primo Intervento, i turni vengono coperti a rotazione dal personale del DEA dell’ospedale di riferimento che è distante circa un’ora, le risorse a disposizione dei sanitari sono veramente poche, ma generalmente gli accessi giornalieri sono esigui e quasi tutti per piccola traumatologia. Il giovane medico d’urgenza di guardia sta riflettendo che quello che sta iniziando potrebbe essere un turno a bassa intensità e sta pensando: “Fortuna che oggi vedrò solo cose di poco conto…”. Poco dopo si presenta alla porta un giovane trafelato che chiede di aiutarlo a far scendere il padre dall’auto perché sta malissimo. Il paziente viene messo in barella e condotto subito in ambulatorio, appare pallido, sudato ed agitato, da circa 15 minuti lamenta un forte dolore retrosternale, oppressivo, che gli toglie il fiato. Questi i parametri del paziente: PA 145/70 mmHg, FC 105 bpm. ritmica, SatO2 95 in aria ambiente con FR 26 a/min. Ad una rapida visita l’obiettività clinica appare nella norma.
Il paziente racconta
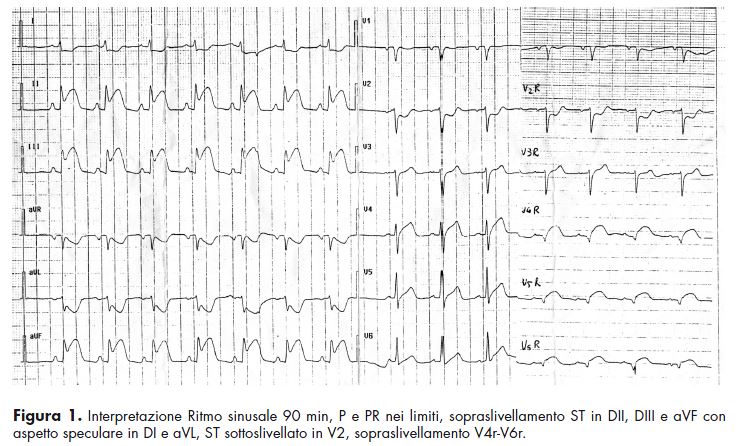
che da un paio di settimane aveva qualche doloretto al torace prevalentemente dopo sforzo, ma non li aveva ritenuti importanti; ha 65 anni, riferisce di non aver patologie, prende solo una pillola per la pressione alta che non ricorda come si chiama, fuma un pacchetto di sigarette al giorno e non ha allergie in anamnesi. Si reperisce un accesso venoso, si registra un ECG (Fig. 1) e si monitorizza il paziente. Il medico d’urgenza ritiene che il paziente abbia un infarto miocardico acuto inferiore e posteriore (sottoslivellamento V2)
ed ipotizzando un coinvolgimento del ventricolo destro richiede anche la registrazione delle precordiali destre; subito dopo inizia la terapia (acido acetil-salicilico 325 mg per os, morfina endovena 4+3 mg, bolo di eparina sodica 4000 UI ev, clopidrogel 600 mg per os). Viene contattato il cardiologo dell’UTIC di riferimento che, dopo aver ricevuto il fax dell’ECG, autorizza il trasferimento presso il centro Hub per le angioplastiche primarie distante poco più di un’ora. L’ambulanza medicalizzata per il trasferimento arriva circa 20 minuti dopo nei quali il paziente si è mantenuto stabile con un discreto controllo del dolore. L’ambulanza è ormai partita in direzione del centro Hub, il giovane medico d’urgenza riflette sul fatto che in questo mestiere turni tranquilli proprio non esistono, ma tutto sommato ritiene di aver gestito bene l’urgenza con i pochi mezzi a disposizione, ha fatto tutto quanto doveva essere fatto, ma nella fretta ha pensato a tutto… meno che alle diagnosi differenziali, anche se il quadro era così suggestivo da non porsi la domanda ”E se non aveva un infarto?”. Alla fine del turno il medico d’urgenza contatta l’Emodinamica dell’Ospedale che ha accolto il paziente per chiedere notizie e gli viene letto il referto della coronarografia: “Tronco comune: indenne da lesioni significative, Ramo IVA: stenosi 45% al terzo medio. Ramo Cx: indenne da lesioni significative. Coronaria destra: irregolarità al terzo medio, stenosi del 85% a livello del primo tratto”. Il collega dell’UTIC lo rassicura dicendogli che la lesione principale è stata brillantemente trattata con uno stent (Figura 2) medicato ed il paziente è ora ricoverato in UTIC in buone condizioni cliniche.
Le ipotesi diagnostiche
Nella diagnostica differenziale del sopraslivellamento del tratto ST, oltre alla immediata ipotesi di STEMI, devono essere prese in considerazione numerose condizioni cliniche che possono presentarsi con pattern elettrocardiografico sovrapponibile o simile (1). Ripolarizzazione precoce. In alcuni soggetti giovani e sani, soprattutto di etnia nera, vi è una variante normale definita ripolarizzazione precoce, il cui pattern tipico è caratterizzato da tratto ST sopraslivellato da 1 a 4 mm
nelle derivazioni precordiali anteriori. Le altre caratteristiche tipiche sono: sopraslivellamento tipicamente dal V2 a V4, più marcato in V4 con presenza di un incavo al punto J; onde T alte e prominenti, mai invertite; tratto ST concavo. Si può associare a ripolarizzazione precoce del tessuto atriale, con sottoslivellamento del tratto PR (2).
Pericardite. In corso di pericardite le alterazioni del tratto ST possono essere caratterizzate da sopraslivellamento diffuso, sia nelle derivazioni precordiali sia nelle derivazioni periferiche, con interessamento quindi del territorio vascolare di diverse coronarie in contemporanea, eventualità rara in corso di IMA; questo può essere di aiuto perciò al clinico nella diagnosi differenziale. Poiché la pericardite diffusa non interessa solo lo strato subepicardico della parete ventricolare (responsabile del sopraslivellamento ST) ma anche lo strato subepicardico della parete atriale, sarà possibile identificare anche alterazioni elettrocardiografiche di danno atriale. Sarà perciò possibile visualizzare in corso di pericardite sottoslivellamento del tratto PR, alterazione però non specifica in quando
identificabile anche in corso di ripolarizzazione precoce o infarto in fase precoce. In caso sia inoltre associato versamento pericardico di almeno moderata entità saranno visualizzabili diffusi bassi voltaggi; infine in caso di versamento di elevata entità, si può visualizzare una modifica costante dei voltaggi, dovuta al movimento continuo del cuore all’interno del liquido pericardico.
Miocardite. La miocardite può causare sopraslivellamento del tratto ST diffusamente, come nella pericardite. Inoltre, la morfologia prominente del tratto ST può mimare quella tipica del sopraslivellamento ST in corso di IMA, rendendo più difficoltosa la diagnosi differenziale (2).
Ipertrofia ventricolare sinistra o cardiomiopatia ipertrofica. In tali condizioni vi può talvolta essere presente un ST sopraslivellato diffusamente in assenza di ischemia miocardica acuta (3-5). Angina di Prinzmetal. In corso di spasmo di un’arteria coronarica epicardica da decorso intramuscolare, il tratto ST risulta sopraslivellato nelle derivazioni che leggono l’area irrorata dalla coronaria stessa, rispecchiando infatti l’ischemia transmurale. In questa condizione, poiché solitamente lo spasmo è di breve durata, le alterazioni del tratto ST sono transitorie ed autorisolventesi. L’alterazione del tratto ST in corso di IMA o in corso di angine di Prinzmetal
sono indistinguibili, in quanto sono sottese dal medesimo meccanismo fisiopatologico: ischemia miocardica in entrambi i casi, causata da trombosi coronarica persistente nel primo caso, da spasmo arterioso transitorio nel secondo. Da sottolineare che, in caso di vasospasmo prolungato, l’ischemia miocardica può esitare in infarto miocardico.
Vasospasmo da cocaina. L’azione della cocaina a livello coronarico può indurre vasospasmo, con conseguente ischemia del territorio vascolarizzato dalla arteria interessata. Poiché la cocaina è in grado inoltre di indurre aggregazione piastrinica con conseguente formazione di trombi su placca o anche in arterie sane, vi può essere trombosi intracoronarica con conseguente infarto miocardico. Le alterazioni dell’ECG sono perciò indistinguibili da quelle in corso di IMA, poiché il meccanismo fisiopatologico che le origina è lo stesso.
Embolia polmonare. In corso di embolia polmonare vi può essere un aspetto da pseudonecrosi anteriore con ST sopraslivellato nelle precordiali anteriori settali ed inferiori con inversione delle onde T, cui si associano però ulteriori molteplici pattern elettrocardiografici tra cui il pattern S1Q3T3, blocco di branca destro completo o incompleto e tachicardia sinusale (6). Iperkaliemia. L’iperkaliemia come causa di sopraslivellamento del tratto ST è ben riconosciuta, con pattern che possono ricordare quelli dell’IMA o della pericardite (aspetto pseudoinfartuale). Si può identificare un marcato sopraslivellamento del tratto ST associato a QRS allargati, onde T a punta prominenti, onda P di dimensione ridotta o assenza di onda P. La diagnosi differenziale con l’IMA può essere aiutata dalla morfologia del tratto ST, che solitamente in corso di iperkaliemia è sopraconcavo mentre in corso di IMA è più facilmente sopraconvesso. L’esecuzione di un ecocardiogramma può essere però di grande supporto per il clinico, che deve escludere anche la possibilità di un coesistente IMA in corso di iperkaliemia qualora la clinica e l’ECG non siano dirimenti. Sindrome di Brugada. In pazienti con anamnesi positiva per sincope o arresto cardiaco ed aspetto elettrocardiografico tipo blocco di branca ds con sopraslivellamento del tratto ST nelle precordiali destre, deve essere posto il sospetto clinico di sindrome di Brugada. La sindrome è stata identificata come responsabile del 40-60% delle fibrillazioni ventricolari idiopatiche, ed è causata da una mutazione del gene del canale del sodio cardiaco. In questa sindrome, il sopraslivellamento dell’ST è solitamente isolato a V1 e V2 e può avere un aspetto a sella; nella morfologia tipica il tratto ST inizia con un’onda R, in seguito cala e termina con un’onda T invertita. Questo pattern è così caratteristico che non può essere confuso con un IMA. Bisogna sempre ricordare che le alterazioni del tratto ST nella sindrome di Brugada possono essere intermittenti, quindi non visualizzabili con constanza.
Dilatazione aneurismatica del ventricolo sinistro post-infartuale. In presenza di aneurisma ventricolare post-IMA, l’aspetto elettrocardiografico è quello di un infarto miocardico nello stadio ST-T con reperto permanente di ST sopraslivellato con onde T invertite (negatività preterminale o terminale). In questa condizione la clinica ed il confronto con precedenti ECG diventano decisivi nell’iter diagnostico-terapeutico (3-5).
Cardiomiopatia (displasia) aritmogena del ventricolo destro. In alcuni casi viene descritto un sopraslivellamento del ST nelle precordiali destre (3,4,6).
Dopo DC shock. Il tratto ST può essere sopraslivellato dopo esecuzione della defibrillazione elettrica. Sono state riportate alterazioni elettrocardiografiche in un numero variabile di pazienti, tra il 10 ed il 20%, caratterizzate da sopraslivellamento del tratto ST di 5 o più mm della durata media di 1,5 minuti, autolimitantesi e regredite spontaneamente senza evidenza clinica o enzimatica di danno miocardico (7).
Infine, altre situazioni patologiche che, seppur raramente, possono presentarsi con quadro elettrocardiografico di sopraslivellamento del tratto ST sono metastasi cardiache di tumori polmonari (8); dissezione spontanea dell’arteria vertebrale (9); ed emorragia intracranica (10).
Discussione
L’infarto miocardico inferiore è dato frequentemente dall’occlusione della coronaria destra, a meno che non vi sia prevalenza della coronaria sinistra, in tal caso (circa il 10%) l’arteria interessata è la circonflessa. Una delle più temibili complicanze dell’infarto miocardico inferiore è la compromissione del ventricolo destro, che si realizza solo quando l’arteria occlusa è la coronaria destra nella regione del primo tratto prossimalmente al ramo marginale.
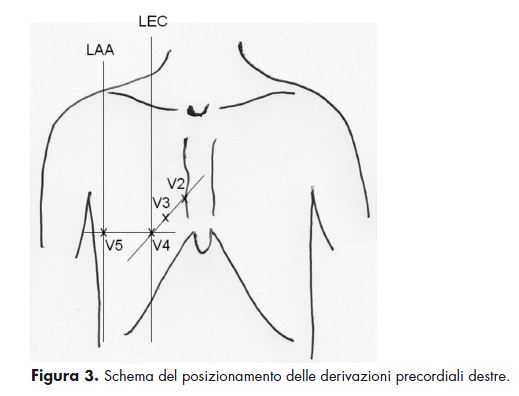
La drammatica riduzione della gittata cardiaca destra conseguente alla miocardionecrosi si ripercuote sul ritorno venoso alle sezioni cardiache di sinistra provocando quadri di ipotensione fino allo shock cardiogeno ed impone un comportamento terapeutico adeguato. Nell’infarto inferiore con coinvolgimento del ventricolo destro va evitata la somministrazione di nitroderivati e diuretici e preso in considerazione l’utilizzo di boli di cristalloidi associati alla dobutamina. Per tale motivo di fronte ad un infarto inferiore è importante escludere il coinvolgimento del ventricolo destro. In questo caso l’utilizzo delle derivazioni precordiali destre non convezionali (V2r, V3r, V4r, V5r, V6r) (Figura 3) risulta essenziale per la diagnosi poiché il riscontro di sopraslivellamento >1 mm in V4r (talora presente anche in V3r, V5r, V6r) possiede una sensibilità del 100% ed una specificità dell’ 82% nel rilevare un infarto del ventricolo destro (11-12).
Le derivazioni destre sono derivazioni precordiali addizionali destre, con elettrodo esplorante posto sull’emitorace destro, in sedi speculari rispetto a quelle tradizionali, in particolare:
• V4R: V spazio intercostale sulla linea emiclaveare destra (LEC);
• V5R: V spazio intercostale sulla linea ascellare anteriore destra (LAA);
• V6R: V spazio intercostale sulla linea ascellare media destra.
L’ECG si posiziona al centro della rete decisionale nel trattamento del paziente con dolore toracico ischemico. Il management del paziente con STEMI inizia dal primo contatto che il paziente ha con il sanitario. La diagnosi tempestiva di STEMI è la chiave di volta per il successo terapeutico.
Nel caso in specie, il cui scenario è rappresentato da un ospedale di periferia con scarse strutture diagnostico-terapeutiche, appare assolutamente congruo il comportamento del giovane medico che si fa indirizzare in particolare dal quadro clinico. A vantaggio della patologia infartuale vi erano tutte le caratteristiche sintomatologiche presentate dal paziente: dolore retrosternale, insorgenza dei sintomi da alcuni minuti, segni disvegetativi, frequenza respiratoria elevata, presenza di vaghi prodromi da sforzo accusati qualche giorno prima. Naturalmente il supporto ecografico risultava determinante nell’avvalorare la prima ipotesi diagnostica del giovane collega e vien fatto di pensare che nessuna figura medica, magari anche di più comprovata esperienza, non avrebbe seguito lo stesso comportamento decisionale. I dubbi successivi di diagnostica differenziale, nella nostra professione, è vero, ci assalgono spesso e volentieri, ma diciamolo pure, fanno parte del nostro scrupolo e il più delle volte sono postumi all’intuito diagnostico che, specie quando non supportati dalla diagnostica strumentale, resta pur sempre il primum movens dell’iter successivo, anche a costo di qualche falso positivo.
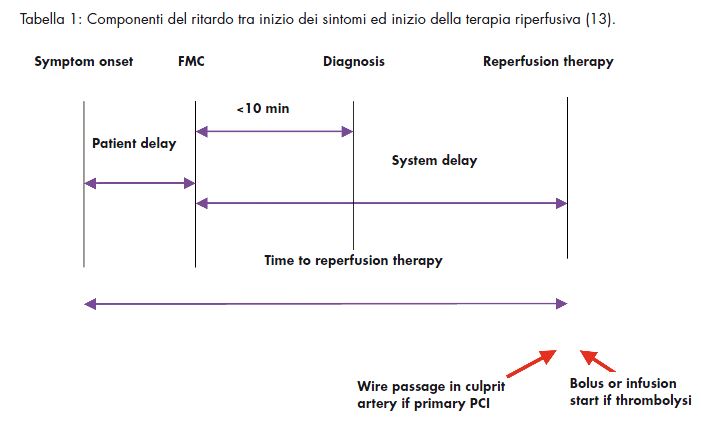
Nei pazienti con STEMI in grado di raggiungere in tempi brevi un centro attrezzato, la PCI primaria è considerata il trattamento ottimale (13). Negli ultimi anni, pertanto, molte reti ospedaliere dedicate alla PCI primaria si sono date un assetto organizzativo finalizzato soprattutto ad accorciare i tempi di trasferimento del paziente dal luogo della prima osservazione clinica al tavolo dell’emodinamica (door to ballon) (vedi tabella 1).
Nei pazienti con STEMI l’ECG è in grado di dare informazioni utilissime sulla sede della lesione, sulla coronaria implicata e sulla quota di miocardio a rischio, e anche dopo trattamento trombolitico o con angioplastica, ci fornisce indicazioni sul grado di riperfusione miocardica e quindi sul rischio di rimodellamento ventricolare postinfartuale. Poiché la rapidità è il fattore chiave, la decisione di far accedere il paziente al laboratorio di emodinamica viene presa dal medico dell’urgenza, in molti casi, sulla base del quadro clinico e dell’ECG standard senza un ricorso sistematico ad esami di II livello. Tutto ciò può teoricamente andare a discapito dell’accuratezza diagnostica complessiva, ponendo il problema dei falsi positivi. Perugini et al. (14) suggeriscono come il numero di falsi positivi e di falsi negativi generato dal percorso diagnostico-terapeutico andrebbe monitorato e utilizzato come uno degli indicatori di qualità del sistema dedicato ai pazienti con sindrome coronarica acuta. La prevalenza di pazienti avviati alla coronarografia urgente per sospetto STEMI senza culprit lesion oscilla tra il 7% e il 20% (15-18). Si tratta prevalentemente di pazienti con coronaropatia cronica, sindrome di Tako-tsubo, miopericardite, embolia polmonare, sindrome aortica acuta, sindrome di Brugada, aspetto a “tipo ripolarizzazione precoce”, ipertrofia o aneurisma del ventricolo sinistro, blocco di branca sinistra di presunta nuova insorgenza, pregresso
infarto, abuso di droghe. Rispetto ai veri STEMI, i falsi positivi per cardiopatia ischemica sono donne, giovani, con una sede più frequentemente anteriore del sopraslivellamento, che ha più spesso un aspetto concavo (15-18).
Attualmente la situazione delle reti dedicate alle SCA è estremamente eterogenea sia per la realtà geografica sia per le soluzioni organizzative adottate. È probabile che i numeri dei falsi positivi rappresentino un “prezzo accettabile” da pagare per un sistema che garantisce un trattamento riperfusivo in tempi rapidi e riduce significativamente la morbilità e la mortalità dei pazienti con STEMI.
La consapevolezza del rischio di falsi positivi può comunque contribuire a ottimizzare i modelli organizzativi delle reti dedicate alla gestione dell’IMA, fermo restando che valori di falsi positivi vicini allo zero si assocerebbero molto probabilmente ad un numero inaccettabile di falsi negativi (14).
Bibliografia
1. Wang K, Asinger RW et al. ST-Segment Elevation in Conditions Other Than Acute Myocardial Infarction. N Engl J Med 2003; 349: 2128-35.
2. Kambara H, Phillips J. Long-term evaluation of early repolarization syndrome (normal variant RS-T segment elevation). Am J Cardiol 1976; 38: 157-61.
3. Fallani M, Zironi G, Valentino A. L’Elettrocardiogramma nell’Urgenza. CG Edizioni Medico Scientifiche, Torino, 2011.
4. Klinge G. The Electrocardiogram. McGraw-Hill, Milano, 1990.
5. Luzza F, Carerj S, Oreto G. Hypertrophic cardiomyopathy with persistent ST segment elevation simulating acute myocardial infarction. Heart 2004; 90(4): 380.
6. Serra S, Di Zio I et al. Sulle tracce dell’ECG. L’embolia polmonare. Italian Journal of Emergency Medicine 2013; 5: 71-75.
7. Van Gelder IC, Crijns HJ et al. Incidence and clinical significance of ST segment elevation after electrical cardioversion of atrial fibrillation and atrial flutter. Am Heart J 1991; 121: 51-6.
8. Roubille F, Cayla G, Gahide G. Cardiac tumor mimicking acute myocardial infarction. Arch Cardiovasc Dis 2008; 101: 677-8.
9. Linden D, Steinke W, Schwartz A, Hennerici M. Spontaneous vertebral artery dissection initially mimicking myocardial infarction. Stroke 1992; 23: 1021-3.
10. Bailey WB, Chaitman BR. Electrocardiographic changes in intracranial hemorrhage mimicking myocardial infarction. N Engl J Med 2003; 349: 561.
11. Oreto G. L’elettrocardiogramma: un mosaico a 12 tessere. Centro Scientifico Editore, Torino, 2009.
12. Breat SH, Brugada P. den Dulk K et al. Value of V4R for recognition of the infarct coronary artery in acute inferior myocardial infarction. Am J Cardiol 1984; 53: 1538-15413.
13. Steg G, James SK, Atar D et al. The Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC). ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. European Heart Journal 2012; 33: 2569-2619.
14. Perugini E, Di Diodoro L, Pallotti MG, Gallelli I, Villani C, Scaramuzzino G, Pancaldi LG, Rapezzi C, Di Pasquale G. La diagnosi elettrocardiografica di infarto miocardico acuto nell’era dell’angioplastica primaria e delle reti hub and spoke. G Ital Cardiol 2010; 11: 630-644.
15. Larson DM, Menssen KM, Sharkey SW et al. “False-positive” cardiac catheterization laboratory activation among patients with suspected ST-segment elevation myocardial infarction. JAMA 2007; 298: 2754-60.
16. Prasad SB, Richards DA, Sadick N, Ong AT, Kovoor P. Clinical and electrocardiographic correlates of normal coronary angiography in patients referred for primary percutaneous coronary intervention. Am J Cardiol 2008; 102: 155-9.
17. Ting H, Rihal CS, Gersh BJ et al. Regional systems of care to optimize timeliness of reperfusion therapy for ST-elevation myocardial infarction: the Mayo Clinic STEMI Protocol. Circulation 2007; 116: 729-36.
18. Gu YL, Svilaas T, van der Horst IC, Zijlstra F. Conditions mimicking acute ST-segment elevation myocardial infarction in patients referred for primary percutaneous coronary intervention. Neth Heart J 2008; 16: 325-31.