- Monti, L.Stefanecchia, G.M.Vincentelli, F.Borgognoni
- Area giovani
Un caso report di torsione di punta acquisita
- 4 - Settembre 2013
- ISSN 2532-1285
Abstract
Torsades de pointes is an uncommon and unique type of ventricular tachycardia. It differs from other forms of ventricular tachycardia by its morphological features, underlying mechanism, and modes of therapy. Prolongation of the electocardiographic QT interval is an established risk factor for torsades de pointes. Some drugs prolong QTc in a dose-dependent manner, others do so at any dose. Implicated drugs include class 1A and III antiarrhythmics, macrolide antibiotics, pentamidine, antimalarials, antipsychotics, arsenic trioxide, and cocaine. Most patients that develop drug-induced torsades de pointes have underlying risk factors. Female sex is the most common. Other predisposing factors known to increase the likelihood of developing torsades de pointes are: electrolyte imbalance (hypokalemia, hypomagnesemia, or both), subarachnoid bleeding, organophosphate insecticides and cocaine. Treatment for torsades de pointes includes immediate defibrillation for hemodynamic instability and intravenous magnesium sulphate. In this article, we will discuss a case report, the nature of QT’s prolongation, describe torsades de pointes and its consequences.
Introduction
La torsione di punta è una tachicardia ventricolare polimorfa caratterizzato da un ciclico spostamento dell’asse del QRS (torsione attorno alla linea isoelettrica), generalmente preceduta da un prolungamento dell’intervallo QT; venne descritto per la prima volta, da Dessertenne in una donna anziana nel 1966 .(1)
È generalmente preceduta dalla sindrome del QT lungo, che puo’ essere congenita o acquisita, essendo il risultato di una complessa interazione tra alterazioni strutturali, metaboliche, genetiche e farmacologiche. (2) Questo articolo si concentra sui meccanismi alla base di prolungamento dell’intervallo QT, i fattori di rischio per torsione di punta e descrive il trattamento della torsione di punta.
Case Report
Paziente, di sesso M, 51 anni, giunge in PS per episodi sincopali recidivanti che non erano stati studiati in precedenza. Il paziente all’anamnesi fisiologica riferisce tabagismo ( 20 sigarette al giorno ), abuso di alcolici ( vino e superalcolici) e cocaina ( 5 gr in totale con una media di 2 volte a settimana), ex-eroinomane in terapia sostitutiva con Metadone cloridrato ( 40 mg/die).
In anamnesi patologica remota il paziente presentava, da 10 anni, diagnosi di ipertensione arteriosa, in trattamento con Ramipril 2,5 mg/die, con scarsa compliance dei valori pressori. All’arrivo in DEA l’Esame Obiettivo evidenziava epatomegalia ( 2 cm dall’arcata costale di consistenza aumentata, superficie liscia) torace FVT diminuito bilateralmente, soffio sistolico 2/6 sul f. mitralico. I parametri vitali evidenziavano Pa 160/90 MmHg F.C. 90 bpm ritmico.
L’ECG presentava ritmo sinusale con intervallo PR corto ( 108 ms) bigeminismo ventricolare extrasistolico. Gli esami ematochimici evidenziavano glicemia 245 mg/dL, creatininemia 2,9 mg/dL,azotemia 37 mg/dL, kaliemia 2,5 mEq/L; calcemia ed indici di miocardio necrosi nella norma.
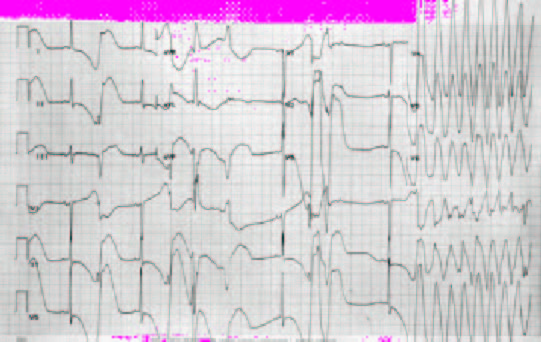
Durante l’Osservazione Breve il paziente veniva monitorizzato e dopo alcuni minuti presentava un ulteriore episodio sincopale; il monitor ECG evidenziava Tachicardia Ventricolare polimorfa con torsione di punta (fig. 1).
Fig.1 Tracciato ECG del paziente
L’aritmia si risolveva spontaneamente senza necessita di cardioversione. Veniva eseguita terapia con magnesio solfato (2 gr in bolo ) poi in infusione continua a 5 mg/min. L’ecocardiogramma eseguito non evidenziava alterazioni significative. Il paziente veniva ricoverato in ambiente cardiologico dove eseguiva, a distanza di 3 giorni dall’ultimo episodio sincopale, un Ecg Holter che documentava : ritmo sinusale con F.C. media di 89 batt/min con intervallo PR 154 ms e QTc 451 ms con numerose extrasistoli ventricolari. La kaliemia era tornata nel range di normalità. Dopo una settimana di ricovero, il paziente si manteneva asintomatico ed in buon compenso emodinamico con assenza di alterazioni del ritmo di base. Per tale motivo i colleghi cardiologi non ponevano indicazione al posizionamento del Pacemaker ed il paziente veniva dimesso in terapia con sartanici, betabloccanti, metadone e benzodiazepine.
Discussione
La Torsione di Punta è una tachicardia ventricolare polimorfa associata a sindrome del QT lungo caratterizzata da oscillazioni del QRS intorno alla linea isoelettrica.
L’allungamento del QT è un stabile fattore di rischio per la torsione di punta. responsabile di un aumento dei potenziali tardivi (3).
Clinicamente può presentarsi in maniera sintomatica con sincope o lipotimia ma rappresenta una condizione di rischio per morte improvvisa; l’elettrocardiogramma che precede la torsione di punta può essere normale o può includere un prolungamento del tratto QT, extrasistoli ventricolari ed intervalli short-long (4).
Nel 90 % dei casi la base fisiopatologica di questa aritmia è dipendente da disfunzione delle correnti ioni durante la fase 3 del potenziale d’azione (5).
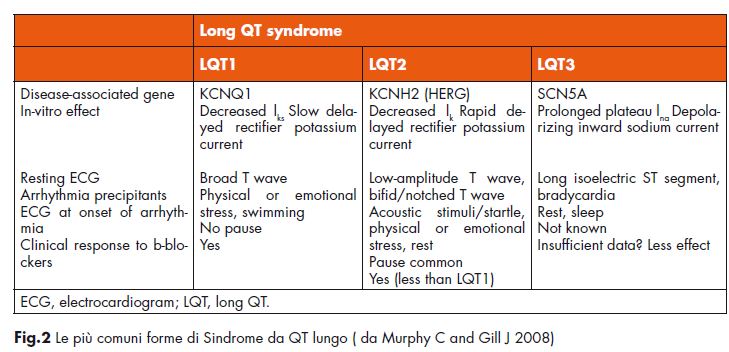
Queste disfunzioni possono essere congenite o acquisite. Le forme congenite è ereditaria o sporadica, con un prevalenza stimata di circa 1:2.000 della popolazione, ed è legata a mutazioni di alcuni geni localizzati sui cromosomi 3,4,7,11,17,21 (6,7) che codificano alcune subunità proteiche dei canali NA e K dipendenti delle membrane cellulari miocardiche, responsabili della ripolarizzazione ventricolare (Fig. 2) (8).
sindrome di Romano-Ward è una variante autosomica dominante della sindrome del QT lungo e è dovuta alle mutazioni dei geni che codificano per le subunità dei canali ionici cardiaci (KCNQ1, KCNH2, SCN5A, KCNE1, KCNE2 e SCN4B) o dei geni che codificano le proteine che interagiscono con i canali ionici cardiaci (ANK2, CAV3, AKAP9 o SNTA1). È trasmessa come carattere autosomico dominante a penetranza incompleta (9).
La sindrome di Jervell e Lange-Nielsen (JLNS) è una variante autosomica recessiva della sindrome familiare del QT lungo caratterizzata da sordità neurosensoriale bilaterale profonda congenita, intervallo QT lungo all’elettrocardiogramma e tachiaritmie ventricolari.
Suddetta sindrome è dovuta alle mutazioni eterozigoti composte o omozigoti del gene KCNQ1 e/o del gene KCNE1 (10).
Nelle forme acquisite i fattori predisponenti sono rappresentati : dall’età avanzata, il sesso femminile, la bradicardia, l’ipertrofia ventricolare sinistra, l’ischemia, la FE bassa, ipokaliemia ed ipomagnesiemia. Nelle forme acquisite si è comunque dimostrato che esistono delle mutazioni silenti simile a quelle presenti nelle forme congenite che restano silenti, in assenza di fattori scatenanti; questo concetto è stato chiamato “repolarization reserve” (11).
La forma acquisita è generalmente associata ad alterazioni metaboliche , cardiopatie e numerosi farmaci ( i più comuni antiaritmici di classe I1 e III, fenotiazine, antidepressivi triciclici, antistaminici, antibiotici, antimicotici, antianginosi) che causano malfunzionamento dei canali ionici (12,13).
L’assunzione di cocaina è una causa, rara, di allungamento del QT ed quindi di torsione di punta (14). La cocaina è in grado di provocare aritmie e morte improvvisa a causa di proprietà farmacologiche sul sistema cardiovascolare.
In particolar modo:
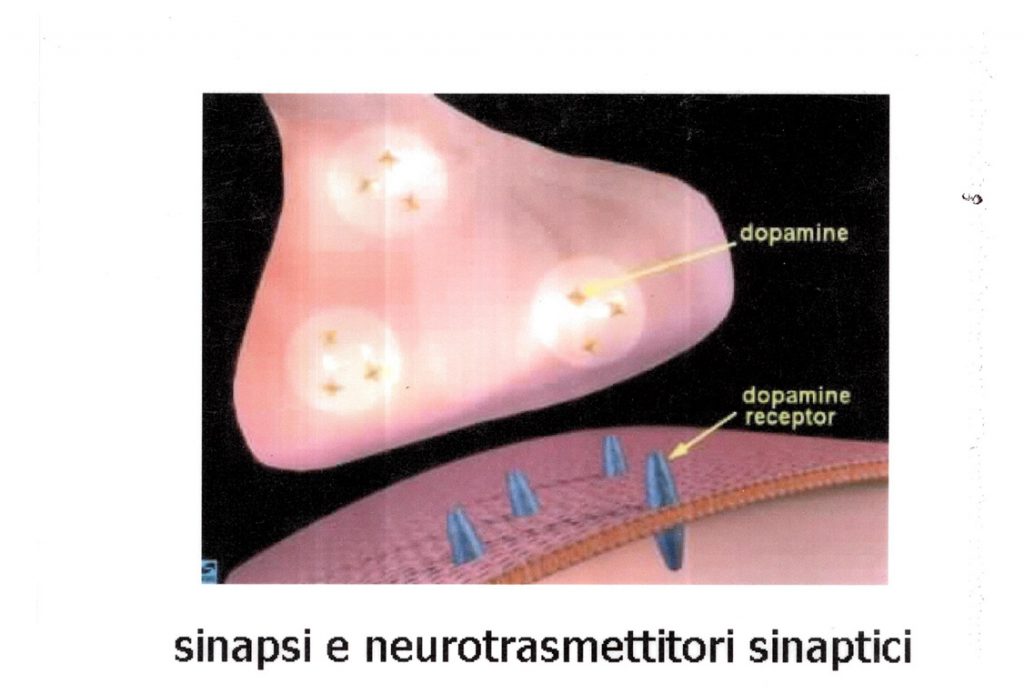
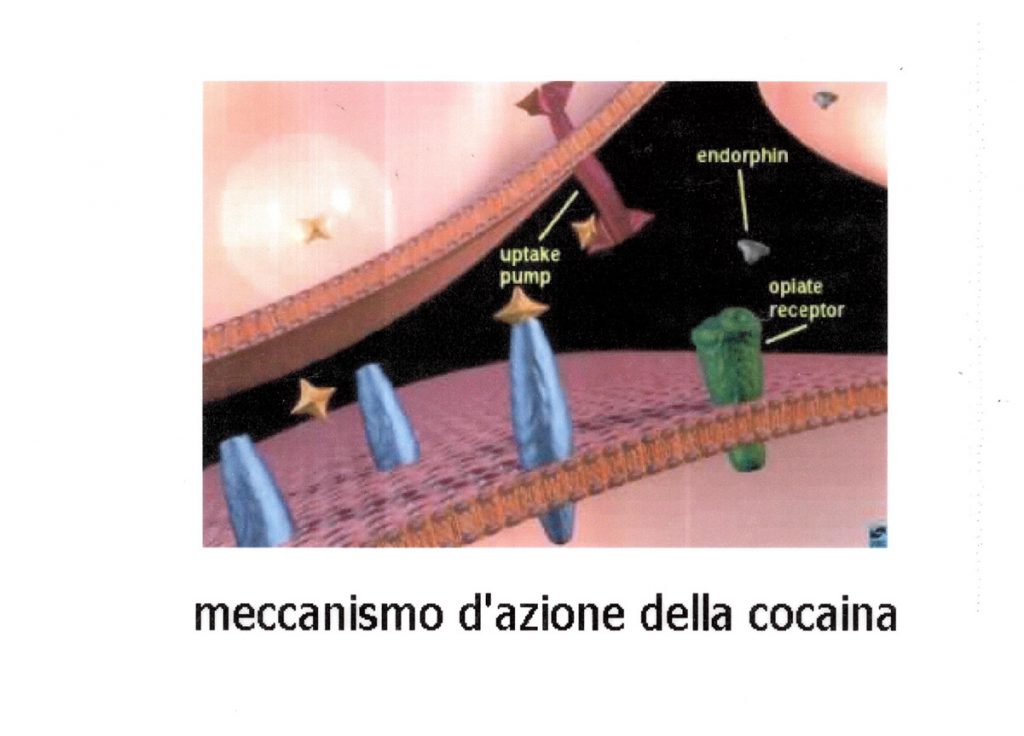
1. blocca il re-uptake ed aumenta il rilascio delle catecolamine dei depositi centrali e periferici provocandone
l’accumulo a livello dei recettori post-sinaptici con intensa stimolazione simpatico-mimetica (fig. 3).
2. rallenta il potenziale d’azione bloccando i canali del sodio
3. blocca i canali del K prolungando la durata del potenziale d’azione ventricolare ed innesca postdepolarizzazioni
precoci (15).
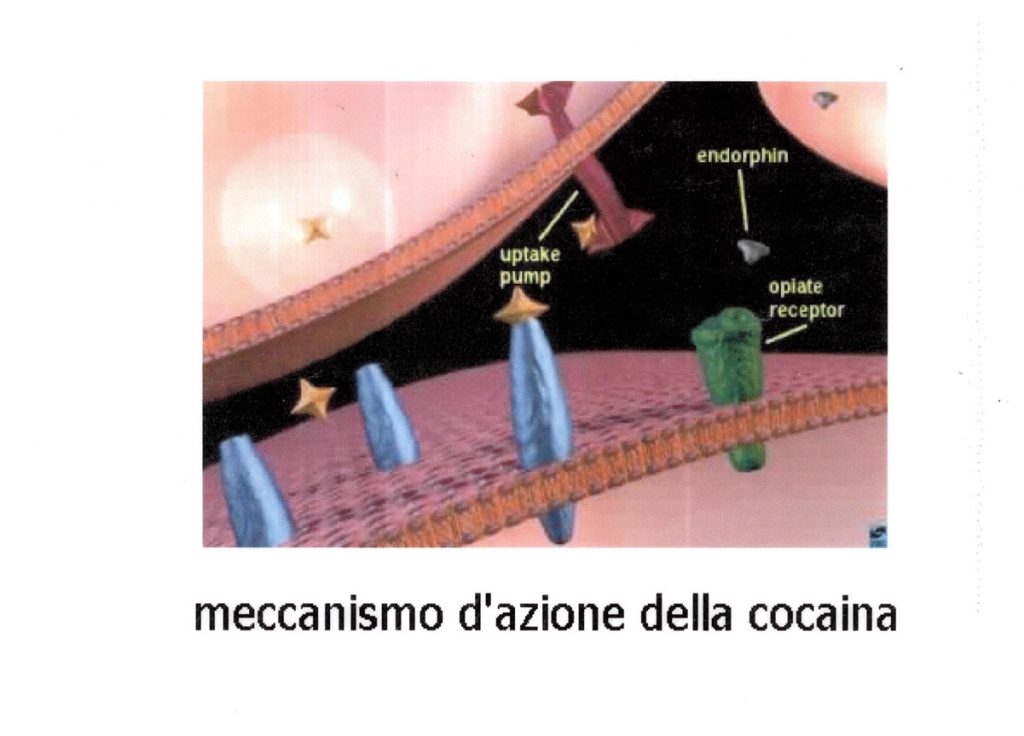
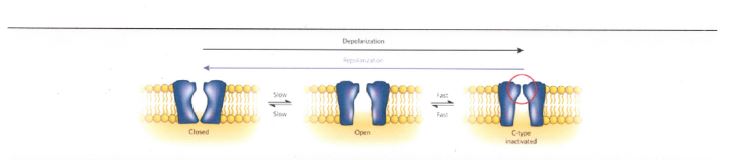
I principali canali del K attivati nelle cellule del miocardio ventricolare durante la fase di ripolarizzazione sono a corrente rapida e lenta e le subunità proteiche sono codificate dai geni HERG e KvLqt1 + minK e la cocaina agisce sui canali HERG inibendoli (16) (Fig. 4).
Fig.4 Funzionamento dei canali HERG
Inoltre i metaboliti della cocaina (norcocaina e coca etilene) antagonizzano i canali del NA e determinano il prolungamento della durata del QRS.
Nel 2013 è stato eseguito uno studio che ha validato un RISK SCORE come test predittivo per il prolungamento del tratto QT.(17)
Terapia
Il Solfato di magnesio per via endovenosa (2 g in bolo seguiti da un’infusione di 2-4 mg / min) è la terapia iniziale di scelta indipendentemente dal livello del magnesio ed il potassio sierico deve essere controllato e mantenuto verso la parte elevata del range (18).
Se l’aritmia è sostenuta ed emodinamicamente instabile è indicato l’utilizzo del defibrillatore (19-20). Il pacing transvenoso temporaneo è un modo efficace di controllare la torsione di punta soprattutto nella Sindrome da QT lungo pausa dipendente (21).
Conclusione
Il quadro clinico del nostro paziente appare in prima ipotesi correlabile ad abuso di cocaina che ha agito come fattore predisponente all’aritmia; a tale fattore si è aggiunto il ruolo fondamentale dell’ipopotassemia nella genesi dell’aritmia, potenziando l’effetto pro-aritmico della cocaina. Inoltre recenti case report hanno evidenziato come anche il Metadone, a dosi però generalmente più elevate di quello che assumeva il nostro paziente, favorisce il prolungamento del tratto QT (22,23).
Il meccanismo coinvolto è l’inibizione della componente rapida dei canali dei ioni IKr, prodotto dal gene hERG (24).
Keys Message
• è fondamentale, eseguire una valutazione del rischio di torsione di punta in pazienti con un allungamento del tratto QT, con un attenta anamnesi fisiologica, familiare e patologica; è auspicabile l’utilizzo di un Risk-Score per predire il prolungamento del tratto QT.
• nei pazienti ad alto rischio è auspicabile effettuare il controllo degli elettroliti ed analizzare attentamente il rapporto rischi-benefici prima di prescrivere farmaci antiaritmici e/o psicotropi.
• una conoscenza più dettagliata dei rischi conferiti da diverse mutazioni genetiche e una attenta ricerca anamnestica dei fattori in causa, anche attraverso la valutazione stratificata, contribuirà ulteriormente a migliorare il processo gestionale di questa sindrome.
Fig.4 Funzionamento dei canali HERG
Inoltre i metaboliti della cocaina (norcocaina e coca etilene) antagonizzano i canali del NA e determinano il prolungamento della durata del QRS.
Nel 2013 è stato eseguito uno studio che ha validato un RISK SCORE come test predittivo per il prolungamento del tratto QT.(17)
Terapia
Il Solfato di magnesio per via endovenosa (2 g in bolo seguiti da un’infusione di 2-4 mg / min) è la terapia iniziale di scelta indipendentemente dal livello del magnesio ed il potassio sierico deve essere controllato e mantenuto verso la parte elevata del range (18).
Se l’aritmia è sostenuta ed emodinamicamente instabile è indicato l’utilizzo del defibrillatore (19-20). Il pacing transvenoso temporaneo è un modo efficace di controllare la torsione di punta soprattutto nella Sindrome da QT lungo pausa dipendente (21).
Conclusione
Il quadro clinico del nostro paziente appare in prima ipotesi correlabile ad abuso di cocaina che ha agito come fattore predisponente all’aritmia; a tale fattore si è aggiunto il ruolo fondamentale dell’ipopotassemia nella genesi dell’aritmia, potenziando l’effetto pro-aritmico della cocaina. Inoltre recenti case report hanno evidenziato come anche il Metadone, a dosi però generalmente più elevate di quello che assumeva il nostro paziente, favorisce il prolungamento del tratto QT (22,23).
Il meccanismo coinvolto è l’inibizione della componente rapida dei canali dei ioni IKr, prodotto dal gene hERG (24).
Keys Message
• è fondamentale, eseguire una valutazione del rischio di torsione di punta in pazienti con un allungamento del tratto QT, con un attenta anamnesi fisiologica, familiare e patologica; è auspicabile l’utilizzo di un Risk-Score per predire il prolungamento del tratto QT.
• nei pazienti ad alto rischio è auspicabile effettuare il controllo degli elettroliti ed analizzare attentamente il rapporto rischi-benefici prima di prescrivere farmaci antiaritmici e/o psicotropi.
• una conoscenza più dettagliata dei rischi conferiti da diverse mutazioni genetiche e una attenta ricerca anamnestica dei fattori in causa, anche attraverso la valutazione stratificata, contribuirà ulteriormente a migliorare il processo gestionale di questa sindrome.