- Manuel Monti
- Articoli originali
Sepsis in Emergency Department: review
- 2 - Maggio 2013
- ISSN 2532-1285
Manuel Monti, Luciano Fioriti, Igino Fusco Moffa, Manolo Filippucci, Francesco Borgognoni
Protocollo per la gestione del paziente con sepsi nei PS/DEA
Studia la sepsi ed imparerai la Medicina d’Urgenza…
Introduzione
Nei DEA e nei Reparti di Medicina i Medici e gli Infermieri debbono confrontarsi quotidianamente con un numero sempre più elevato di pazienti affetti da malattie infettive; ciò presuppone che il personale debba possedere una conoscenza trasversale su tale argomento, partendo da una migliore comprensione dei principi di fisiopatologia e microbiologia, per avere padronanza nel richiedere i provvedimenti diagnostico-terapeutici specifici più appropriati, che si concludono con l’utilizzo degli antibiotici più adatti nelle varie situazioni.
L’obiettivo globale della World Sepsis Alliance per il 2020 è diminuire l’incidenza della sepsi di almeno il 20% tramite un miglioramento delle misure igieniche e mediante programmi di vaccinazione e riduzione del tempo necessario per ricevere interventi di base antimicrobici e i fluidi endovenosi in conformità alle Linee Guida di consenso internazionale.
Per tale motivo questo articolo ha lo scopo di definire un Protocollo per la gestione del paziente con sepsi nei Pronto Soccorsi dell’Azienda USL Umbria 1, tenendo conto della particolare organizzazione dell’Azienda, dei vari Servizi presenti sul territori e delle specificità dei singoli Presidi Ospedalieri. In particolar modo è stato svolto per la prima volta uno studio sull’epidemiologia microbiologica locale insieme al Dipartimenti Prevenzione dell’Azienda, che ha permesso di utilizzare schemi di terapia antibiotica specifica per il nostro territorio. Gli strumenti del Medico che lavora nelle ‘piccole’ realtà ospedaliere, affinché possa riconoscere una patologia così importante con una correlazione stretta tra l’inizio precoce del trattamento ed una prognosi assai più favorevole, devono essere prevalentemente clinici e molto mirati e avvalersi delle tecniche diagnostiche di prima linea.
Nel contempo è estremamente importante identificare con sufficiente precisione il focus che ha originato la sepsi ed il patogeno verso cui rivolgere la terapia antibiotica.
Fisiopatologia della sepsi
La sepsi è una sindrome clinica caratterizzata da una serie di alterazioni secondarie ad un processo infettivo e provocata da una abnorme risposta infiammatoria dell’organismo. L’evoluzione può essere progressiva verso la sepsi severa con comparsa di segni di disfunzione d’organo, ipotensione e alterazioni dell’emostasi, fino al quadro dello shock settico con ipoperfusione resistente al trattamento (1).
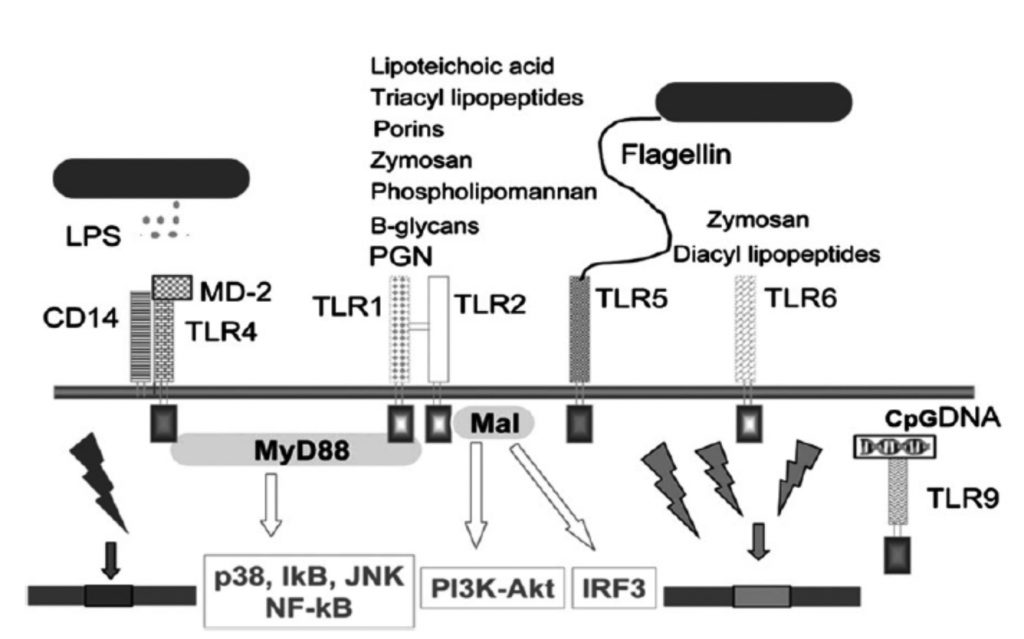
La progressione della sepsi dipende da un riconoscimento e da una terapia tardiva, dall’aggressività del microrganismo in causa e dalle difese immunitarie del soggetto colpito (2). Jones ha definito in maniera brillante la sepsi come un “complesso puzzle” dove, in risposta ad una infezione, si scatena una serie di reazioni, come l’infiammazione, la disfunzione endoteliale, le alterazioni del sistema coagulazione-fibrinolisi e altri fattori (3). È noto che il processo settico si innesca con il riconoscimento del microrganismo o di parti di esso (Pathogen Associated Molecular Patterns) da parte dei Pattern Recognition Receptors delle cellule dell’immunità innata. Questa interazione attiva gli Intracellular Signalling Pathway (sistemi di comunicazione intracellulari) che stimolano i fattori di trascrizione per le interleukine e tutti i mediatori della flogosi (fig. 1) (4).
Figura 1. Adapted from Cinel I, Opal SM. Molecular biology of inflammation and sepsis: a primer. Crit Care Med 2009;37(1):291–304.
Il bersaglio di tali mediatori della flogosi sembra essere un organo ubiquitario come l’endotelio, che non ha soltanto funzioni strutturali, ma possiede un ruolo fondamentale nella OMEOSTASI e soprattutto nell’EMOSTASI (5).
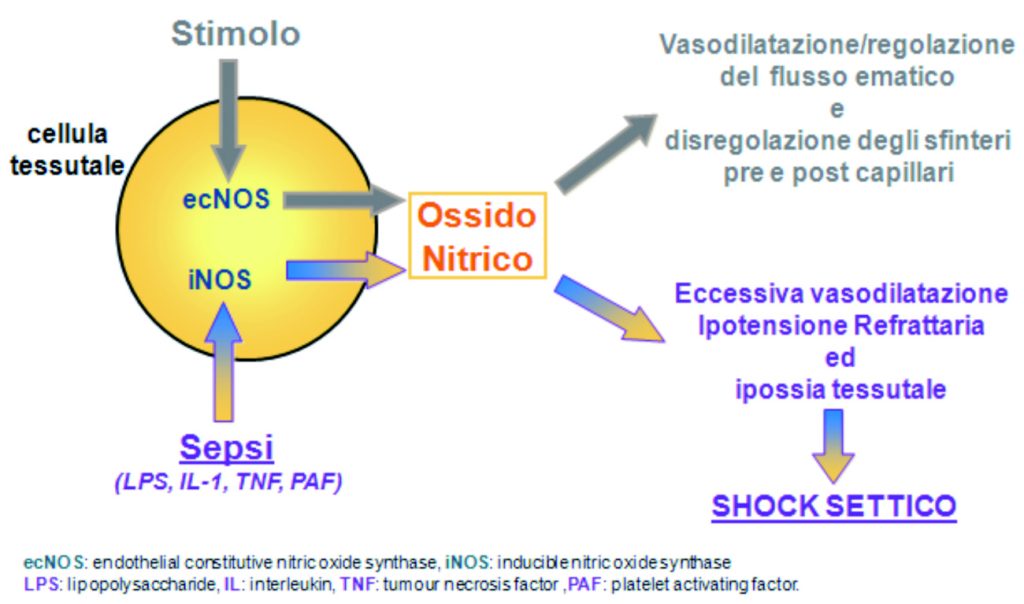
Il contatto tra TNF e il suo recettore endoteliale facilita il rilascio di citochine proinfiammatorie (IL1, IL6, IL8), così che la cellula endoteliale assume un ruolo centrale nell’amplificare la risposta infiammatoria. L’espressione di molecole di adesione sull’endotelio facilita l’interazione di questo con i leucociti, il rilascio di ulteriori mediatori con effetti anche vasomotori che determinano un aumento della permeabilità vasale e la formazione di edema interstiziale, con attivazione della via comune della cascata coagulativa che, unitamente ad un deficit funzionale del sistema fibrinolitico, genera uno stato procoagulante che facilita la trombosi microvascolare (6). È inoltre assai importante il ruolo dell’Ossido Nitrico (NO) nell’evoluzione verso lo shock settico a causa dei suoi effetti citotossici e vasomotori, che comportano un’eccessiva vasodilatazione con ipotensione refrattaria e ipossia tissutale. L’Ossido Nitrico è prodotto dalle cellule endoteliali a seguito di uno stimolo meccanico esercitato dal flusso sanguigno (shear stress) e dalla liberazione di numerosi mediatori chimici (ACh, BK, VIP (7).
Recenti studi evidenziano come la carenza del recettore per le chemochine (CXCR2), che ha come principale conseguenza l’incapacità del neutrofilo di arrivare nel sito di infezione, sia legata alla produzione di NO (8, 9). Inoltre quest’ultimo riduce la diapedesi neutrofilia e l’espressione di molecole di adesione endoteliali utili per mantenere l’equilibrio della risposta infiammatoria (fig. 2) (10, 11).
Figura 2. Fisiopatologia della sepsi. Bertazzoni G, Boccardo C, Prevention
and Research Supplement II Vol 2 N°4 2012;34-37.
Da un punto di vista clinico, queste alterazioni giocano un ruolo primario nella ridotta capacita dei settici di eradicare l’organismo infettante e spiegano la loro suscettibilità ad infezioni nosocomiali secondarie. Inoltre è stato dimostrato come i pazienti settici mostrino una ridotta reazione di ipersensibilità di tipo ritardato e presentino spesso la riattivazione di virus quiescenti (herpes zoster e citomegalovirus) (12, 13).
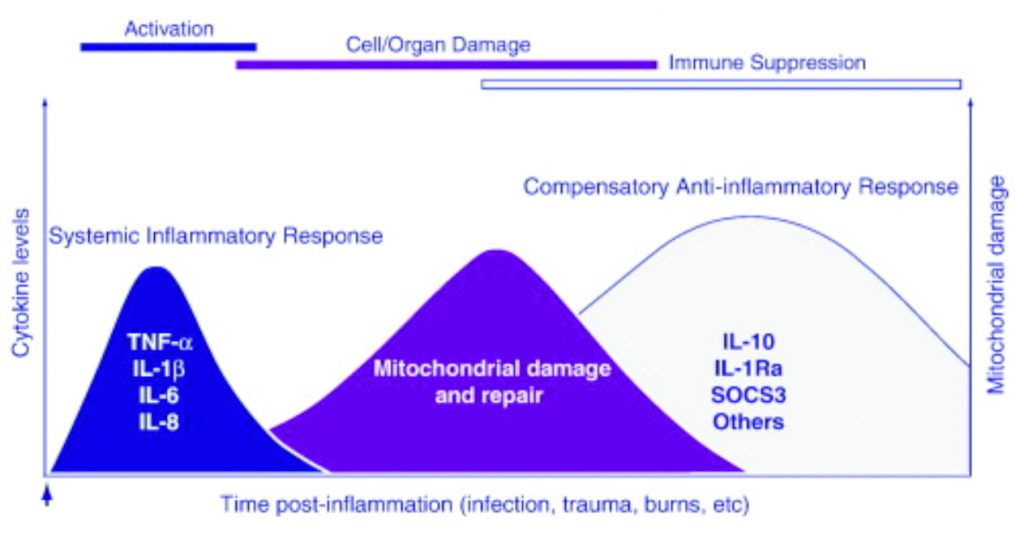
In conclusione, accanto ai meccanismi pro-infiammatori e pro-coagulanti classicamente descritti, stanno emergendo negli ultimi anni meccanismi compensatori per bilanciare la risposta infiammatoria che vengono definiti CARS (Compensatory Anti-inflammatory Response Syndrome) e che possono diventare la causa stessa di un’alterazione dell’equilibrio tra il processo pro-infiammatorio e la risposta anti-infiammatoria, creando numerosi danni (fig. 3) (14, 15, 16, 17, 18).
Figura 3
Obiettivi del progetto
L’obiettivo del progetto, che richiama le indicazioni della Dichiarazione di Barcellona del 2009, la quale indica tra le priorità la definizione di Protocolli e Percorsi delle singole realtà Ospedaliere, è la stesura di un Protocollo per la gestione del paziente con sepsi nei Pronto Soccorsi dell’Azienda USL Umbria 1.
La speranza è quella di aumentare l’attenzione da parte del Personale Sanitario verso l’elevata incidenza della sepsi e l’alto tasso di mortalità ad essa legato, di permettere una pronta e accurata diagnosi con definizioni chiare ed universalmente accettate e di iniziare il trattamento più adeguato possibile mediante l’utilizzo di trattamenti terapeutici specifici.
Tali obiettivi verranno raggiunti attraverso la definizione di Linee Guide applicabili alla nostra realtà ospedaliera e attraverso corsi di formazione per il personale sanitario interessato. Il monitoraggio del Protocollo avrà alcuni indicatori di processo, che evidenzieranno annualmente il grado di aderenza ai protocolli diagnostici-terapeutici e alcuni indicatori di esito che correleranno il rapporto tra pazienti guariti e pazienti con sepsi.
Epidemiologia
Nonostante l’epidemiologia della sepsi non sia ben conosciuta a causa dell’assenza di studi di coorte prospettica della popolazione generale, è emerso dalla letteratura un sostanziale aumento dell’incidenza della sepsi durante gli ultimi decenni, seppur associato ad un calo complessivo della mortalità ospedaliera (19).
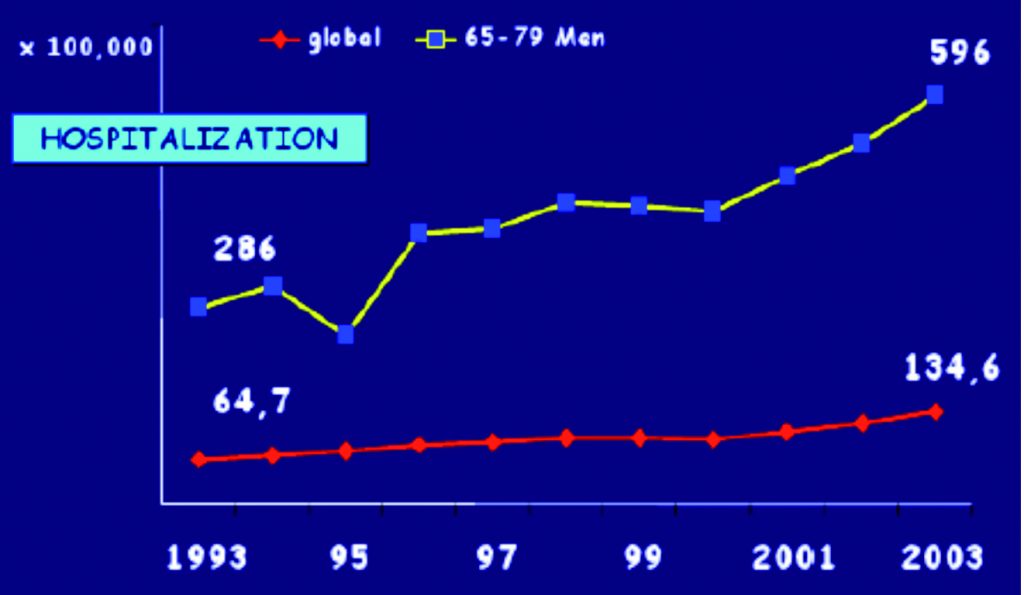
Sebbene sia difficile quantificare accuratamente l’incidenza di sepsi in Pronto Soccorso, i dati esistenti indicano circa 458.000 casi che annualmente giungono in Pronto Soccorso negli USA. Martin (20) ha identificato negli USA più di 10.000.000 di casi di sepsi su una popolazione di 750.000.000 pazienti ospedalizzati in un periodo di 22 anni, con un incremento della frequenza da 82,7 casi /100.000 a 240 casi/100.000 (incremento annuale dell’8,7%) (Fig.4).
Figura 4. Dombrovskiy VY et Al, Clin Care Med 2007; 35:1244-1250
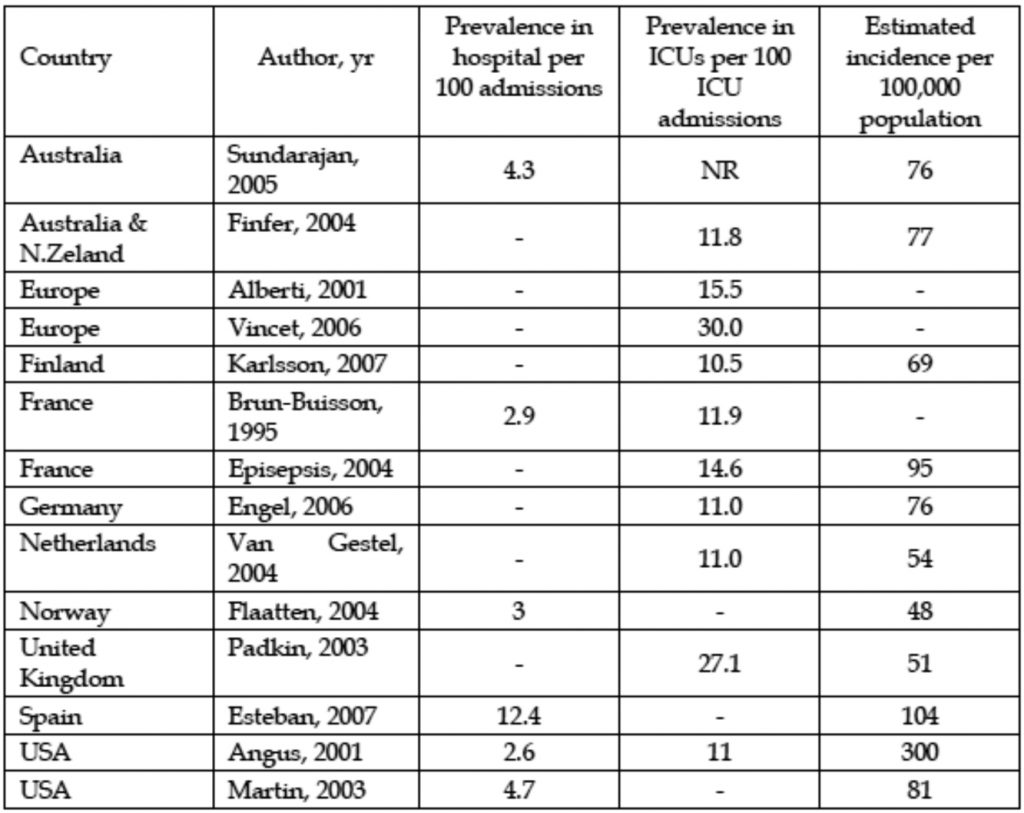
Numerosi studi successivi hanno confermato questo aumento (Tab.1).
Tabella 1. Prevalence of severe sepsis several studies around the world. Dellinger P et Al 2009. Sepsis handbook
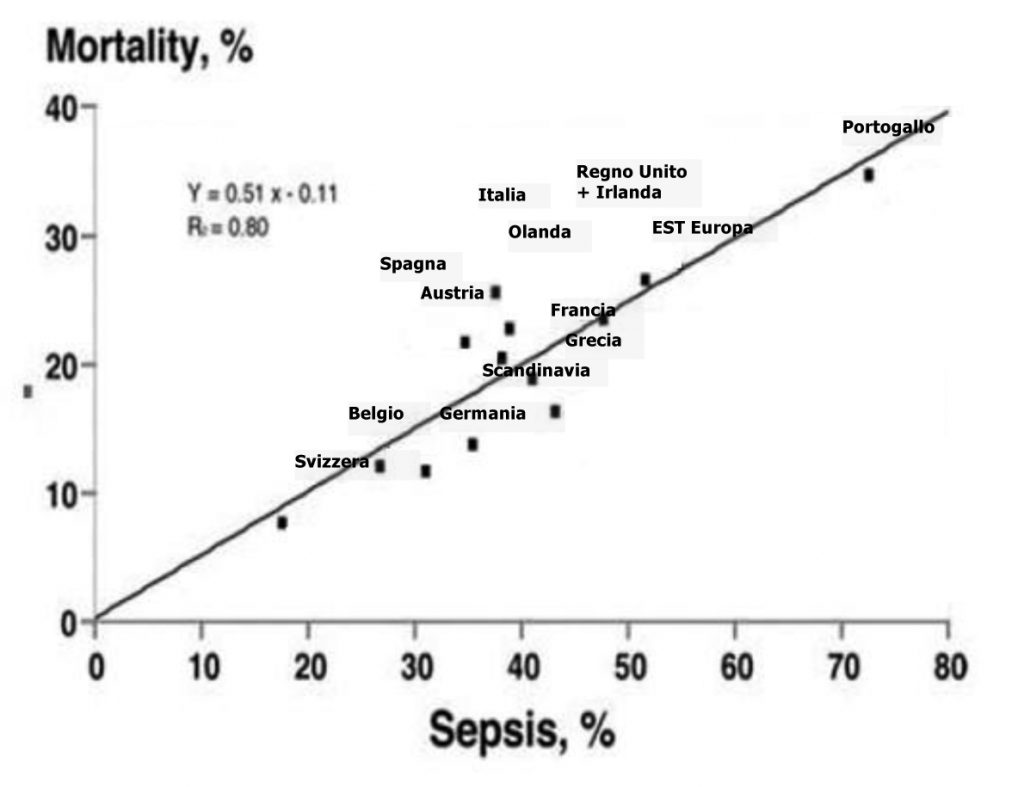
Uno studio osservazionale multicentrico prospettivo europeo (Vincent Soap Study 2006), condotto per valutare l’epidemiologia della sepsi nelle ICUs, ha mostrato marcate differenze di frequenza della sepsi tra i diversi paesi europei, con una mortalità più elevata nei paesi che presentavano una frequenza maggiore (fig.5) (21).
Figura 5. Vincent Soap Study 2006.
In pazienti con sepsi, il polmone è il sito più comune di infezione (68%), seguito dall’addome (22%). In questo studio sono risultate positive il 60% delle emocolture eseguite a pazienti con sepsi. Gli organismi più comuni erano lo Staphylococcus aureus (30%, di cui 14% meticillino-resistente), i Pseudomonas (14%) e l’Escherichia coli (13%) (22).
Tradizionalmente, fino alla fine degli anni Ottanta, i Bacilli GRAM- (Escherichia coli, Pseudomonas aeuriginosa, Klebsiella pneumonia) avevano una prevalenza maggiore rispetto ai GRAM+; negli ultimi decenni, invece, Guidet e numerosi altri studiosi hanno evidenziato che i più comuni germi isolati con le emocolture risultano essere i
GRAM+ cocci (23, 24).
In un recente studio francese è stato evidenziato che i principali batteri presenti nelle emocolture sono lo Streptococcus pneumoniae (17,4%), lo Staphylococcus aureus meticillino-sensibile (11,6%) e meticillinoresistente (4,2%). I Bacilli GRAM- sono stati trovati nel 43,2%: Escherichia coli (15,8%), Klebsiella (5,3%) e Pseudomonas aeruginosa ticarcillina-sensibile (4,7%) e ticarcillina-resistente (3,7%); i Batteri anaerobi rappresentavano il 3,7% e la Candida era presente nel 2,6% dei casi (25).
Sebbene sia difficile quantificare accuratamente l’incidenza della sepsi, in Italia presso i Pronto Soccorsi esistono dati che consentono di registrare l’accesso di 26.000 pazienti all’anno nei reparti di terapia intensiva per pazienti affetti da sepsi severa (il 17,2%) e di 6.550 pazienti all’anno ricoverati per shock settico. È importante notare, inoltre, che circa il 60% dei casi di sepsi evolve in sepsi severa, ossia associata ad insufficienza multi organica. La mortalità complessiva in Italia varia tra il 40% per la sepsi severa ed il 70% per lo shock settico (26).
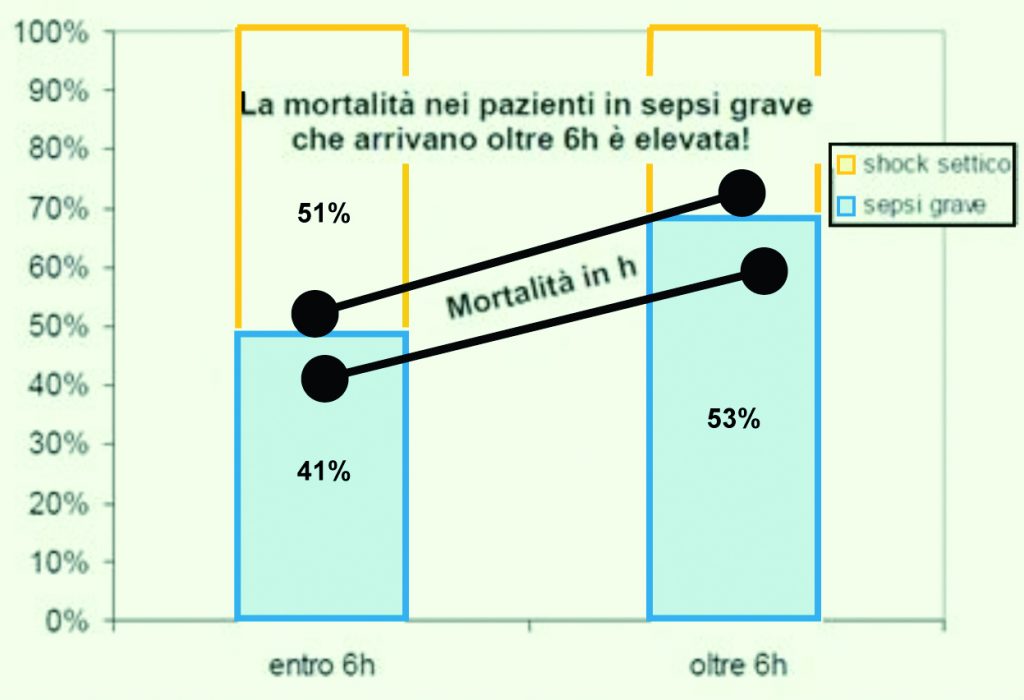
Vi è però un recente studio toscano che ha coinvolto 26 centri, in cui l’applicazione corretta dell’EGDT (Early Goal Directed Therapy) ha permesso di avere un’altissima appropriatezza di ricovero dei pazienti affetti da sepsi severa/shock settico, raggiungendo in quest’ultimo caso il 75% di ricovero entro sei ore in terapia intensiva, seppure sia ancora relativamente basso lo stretto rispetto nell’attivazione dell’EGDT (entro 6 ore) per i pazienti provenienti dal pronto soccorso. È stato evidenziato come, nel rispetto della letteratura scientifica internazionale, la mortalità nei pazienti in sepsi severa che ricevono terapie tardive oltre la sesta ora sia più elevata (fig.6) (27).
Figura 6. Dati Servizio Sanitario Regione Toscana anno 2009.
Valutazione iniziale
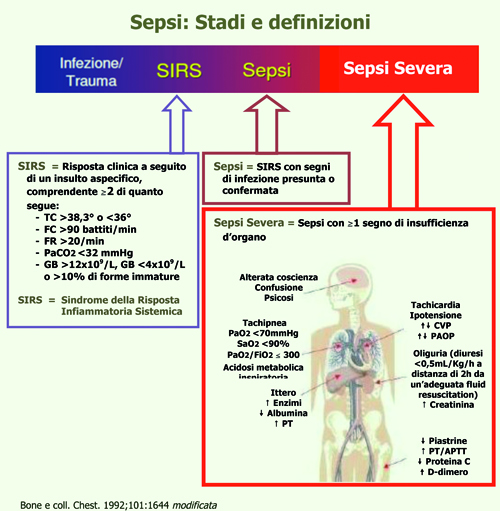
Molti autori paragonano la Sepsi ad una condizione che necessita un trattamento d’Urgenza-Emergenza alla pari dell’IMA, dell’ICTUS Cerebri e dei Politraumi (28, 29, 30), ma sottolineano la difficoltà nel rilevare i segni della sepsi, che sono spesso molto sottili. Dal 1991 è presente una classificazione clinico-fisiopatologica della sepsi (fig. 7):
Figura 7. Sepsi: stadi e definizioni. Bone e coll. Chest. 1992;101:1644 modificata.
L’identificazione del paziente durante la “golden hour” è fondamentale, poiché l’inizio precoce del trattamento si correla direttamente e strettamente ad una prognosi più favorevole, mentre un ritardo nella terapia nelle prime ore può significare la progressione verso un’insufficienza d’organo (31).
La Surviving Sepsis Campaign (SSC) dichiara l’importanza di iniziare il trattamento entro sei ore dal ricovero per i pazienti con sepsi ed entro la prima ora in caso di shock settico (32): ciò perché sei ore rappresentano la definizione operativa della “golden hour” nella sepsi.
La terapia precoce è detta “goal-directed” (EGDT), frase coniata per descrivere la costellazione di interventi finalizzati per il riconoscimento rapido del paziente con sepsi e per la “care” di prima linea degli operatori sanitari, condizioni fondamentali per migliorare l’outcome del paziente con sepsi (33).
Criteri di identificazione
Triage
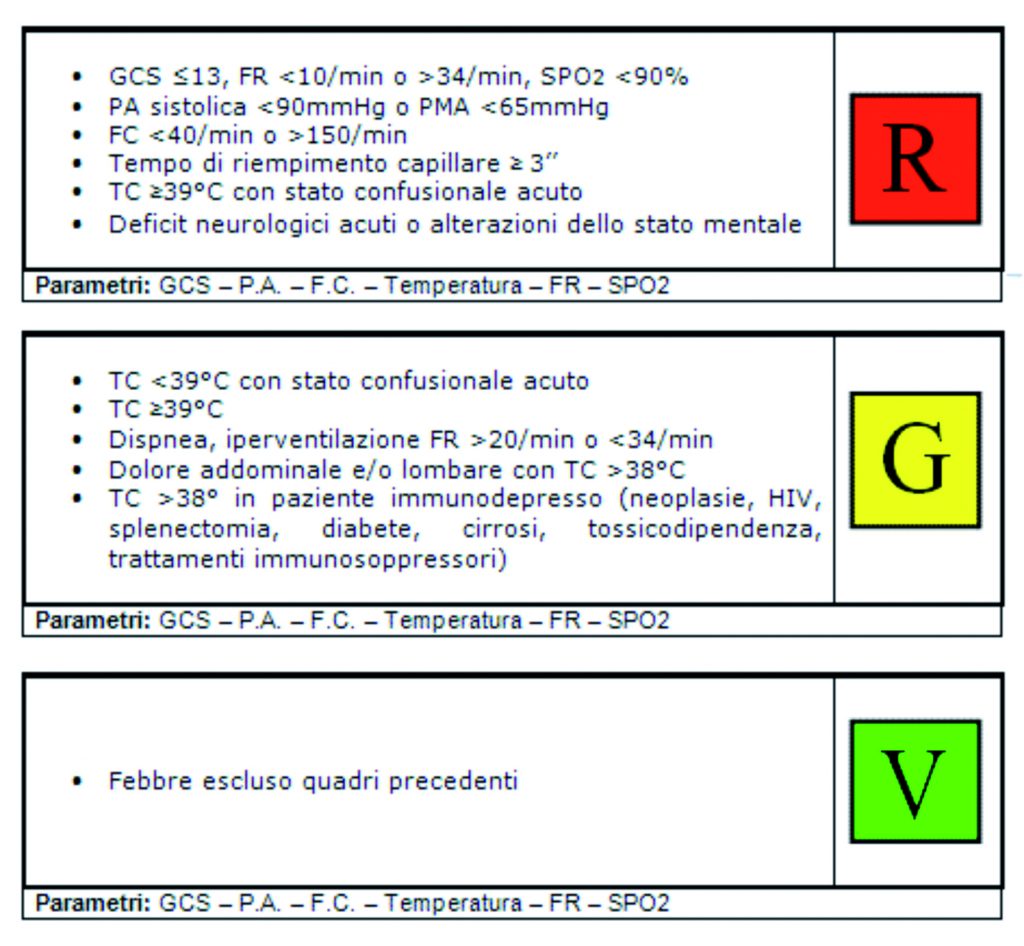
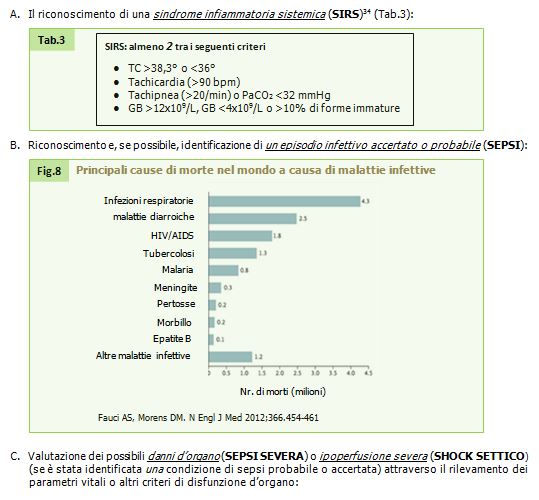
Già dalla fase di Triage, il personale addetto deve sottoporre il paziente ad una valutazione anamnestico-obbiettiva che miri ad identificare eventuali elementi propri della condizione di un paziente infettivo ed il suo stato emodinamico. Ciò avviene attraverso il consueto schema ABCD, prestando particolare attenzione alla misurazione della FC>90bpm, FR>20/min, TC ed altri dati utili (es. patologie immunodepressive e/o terapie immunosoppressive e/o valori di laboratorio indicanti GB<4000 o GB>12000). Alla conclusione della valutazione verrà attribuito un codice colore di priorità (tab. 2):
Tabella 2. “Sospetto sepsi” codici colore Triage Pronto Soccorso. Protocollo per l’assegnazione dei codici colore al Triage di Pronto Soccorso. Azienda USL Umbria 1.
Valutazione Medica
I criteri di identificazione iniziale per un paziente che si presenta in Pronto Soccorso o che si trova ricoverato in
ambiente ospedaliero con possibile sepsi prevedono:
Di conseguenza, durante la visita medica iniziale, è necessario eseguire:
1. Raccolta anamnestica dettagliata ed esame obiettivo completo;
2. Misurazione dei parametri vitali (PA, FC, FR, SpO2, TC);
3. Prelievi ematochimici: emocromo, funzionalità renale, pancreatica ed epatica, coagulazione, indice di flogosi, EGA con GAP anionico e dosaggio dei lattati, eventuali emocolture;
4. ECG;
5. Richiesta di indagini diagnostiche (RX torace, Eco-addome, eventuali rachicentesi e TC-Encefalo);
6. Eventuale inizio trattamento.
Tra gli accertamenti microbiologici il ruolo fondamentale è ricoperto dall’esecuzione delle emocolture per la ricerca di germi aerobi/anaerobi, da eseguire il più precocemente possibile da due accessi venosi periferici a distanza di 30 minuti, indipendentemente dalla TC e annotando l’orario di esecuzione. In pazienti con CVC si renderà necessaria l’esecuzione di emocoltura sincronizzata tra l’accesso CVC e la vena periferica, segnalando l’orario e i siti di prelievo. In caso di presenza di Catetere Vescicale o alterazione della diuresi, eseguire gli esami delle urine, l’urinocoltura ed effettuare un tampone cutaneo per aerobi/anaerobi in caso di ulcere e/o ferite e/o siti cutanei verosimilmente infetti (35).
Tabella 5. Flow-Chart per ottenere un prelievo venoso per emocoltura.
Mermel LA, Maki DG,: Detection of bacteremia in adults. Consequences of culturing an inadeguate volume of blood. Ann Intern Med 1993; 119:270-272 modificato. Nunzio Passera Cap.18 (Prelevare campioni di laboratorio). Manuale di tecniche e procedura infermieristi Chendi Taylor, un approccio al processo di Nursing, di Pamela Lynn. Edizione italiana a cura di Ausilia M.L. Pulimeno. presentazione di Gennaro Rocco; IIed 2010 PICCIN modificato.
La somministrazione di antibiotici diminuisce, ma non annulla, la possibilità di emocoltura positiva, quindi il prelievo dovrebbe essere effettuato prima della terapia antibiotica, tenendo presente che le linee guida internazionali affermano che la terapia antibiotica non deve essere significativamente ritardata nel caso gli esami colturali non possano essere effettuati tempestivamente (36).
Inoltre, le indagini diagnostiche dovrebbero essere eseguite precocemente per determinare la sorgente dell’infezione e il microrganismo in causa. Dovrebbero essere effettuati studi di “imaging” e campionamenti di sorgenti probabili di infezione; tuttavia, alcuni pazienti possono essere troppo instabili per garantire certe procedure invasive o un trasporto fuori della Terapia Intensiva. Possono allora essere utili, in queste circostanze, gli studi al letto del paziente, come gli ultrasuoni (37).
Un altro importante intervento precoce è il controllo della sorgente del sito dell’infezione: ciò comprende l’allontanamento, ove possibile, di qualsiasi oggetto infetto (ad esempio un device), lo sbrigliamento del tessuto necrotico, il drenaggio di ascessi e la terapia antibiotica (38).
È stato dimostrato che le culture microbiologiche in pazienti sospettati fortemente di avere sepsi sono positive in circa la metà dei casi, parzialmente a causa di problemi tecnici della cultura ed il tempismo di raccolta di campione; di conseguenza è stato stabilito che per eseguire la diagnosi di infezione, essa può essere sospettata solamente senza essere microbiologicamente confermata ed è quindi possibile iniziare il trattamento terapeutico (39, 40, 41).
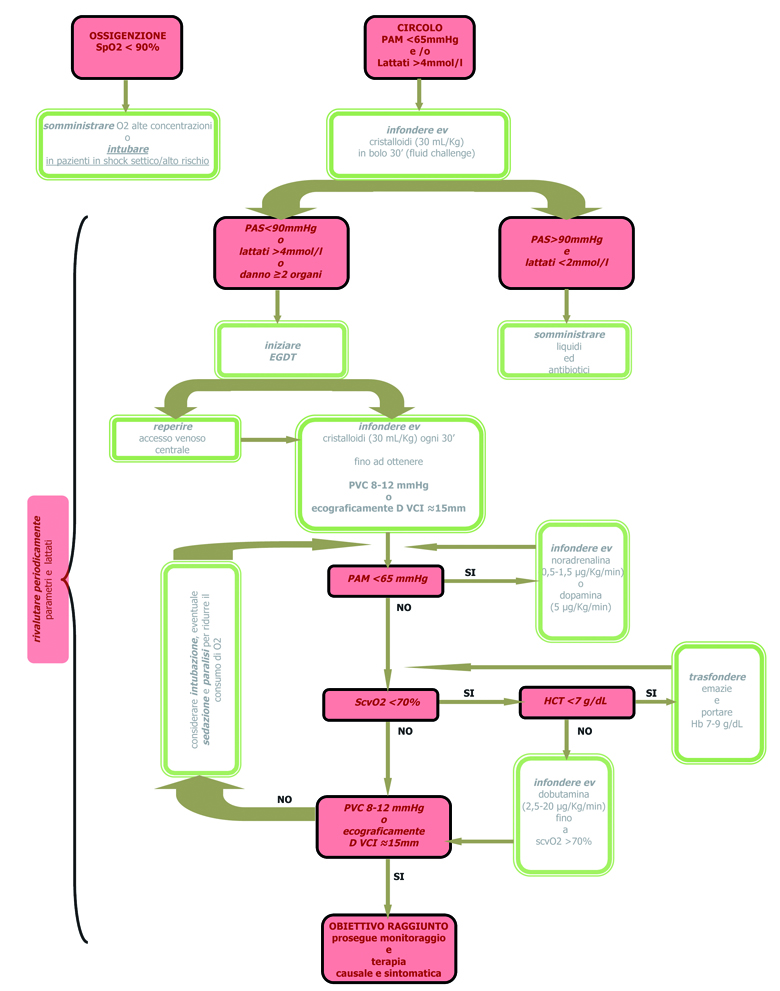
I parametri fondamentali da considerare nel Paziente Settico in evoluzione verso lo shock sono lo stato emodinamico e l’ipossiemia. È lo stato di riempimento vascolare ad influenzare la perfusione e, quando quest’ultima si altera, si è già instaurato il danno d’organo.
Per valutare lo stato di riempimento sarà necessario innanzitutto considerare la clinica del paziente (sensorio, temperatura, stato delle giugulari, polmoni umidi, edemi periferici, parametri vitali, diuresi), per procedere poi a valutazioni non cruente o cruente (monitoraggio della PVC): queste ultime hanno il limite di essere influenzate dalla compliance ventricolare, dalla pressione intratoracica (per esempio in corso di ventilazione meccanica) e dal tono delle vene centrali, non riflettendo con esattezza lo stato di riempimento vascolare del paziente. Tra le metodiche non cruente l’ecografia è quella che suscita attualmente maggiore interesse per la sua capacità di distinguere con esattezza il paziente ‘asciutto’ da quello ‘bagnato’. Esiste, infatti, una correlazione tra diametro della vena cava
inferiore, il suo indice di collassabilità e PVC e ciò permette di classificare come ‘vuoto’ un paziente con diametro della vena cava minore di 15 mm, completo collasso durante l’inspirio, cui corrisponde un valore di PVC inferiore a 5 mmHg. Si classificano ‘pieni’ pazienti con un diametro della vena cava inferiore maggiore di 25 mm, collasso assente durante l’inspirazione, cui corrisponde una PVC di 15-20 mmHg (fig.9) (42, 43).
Valori standard, che esprimono una normalità dello stato di riempimento, sono un diametro della VCI di 20 mm con collasso inspiratorio del 50%. Un altro aspetto utile dell’ecografia risiede nella valutazione dell’imbibizione polmonare in base al numero di ‘comete’: queste vengono considerate assenti se minori di 5, parametro corrispondente alla normalità, lievi tra 5 e 15, moderate tra 15 e 30 e gravi se maggiori a 30; questi valori esprimono la quantità di acqua presente nel parenchima polmonare. L’ecocardiografia consente invece una valutazione delle dimensioni e della performance dei ventricoli, della gittata sistolica e della frazione d’eiezione. Spesso si riscontra in questi pazienti un’iniziale disfunzione diastolica, che progredisce man mano verso la disfunzione sistolica (44).
Figura 9. Correlazioni VCI e P.at. Dx (PVC)Reinhart K. et al. Continuous central venous and pulmonary artery oxygen saturation monitoring in the critically ill. Intensive Care Med 2004;30(8):1572-8 modificata.
Altro concetto fondamentale da considerare nel paziente con sepsi è l’ipossia tissutale. In presenza di alterazioni del precarico, postcarico, contrattilità e trasporto di O2, le cellule mettono in atto meccanismi di compenso che si traducono in un’aumentata estrazione di ossigeno dal sangue arterioso a livello tissutale. Questo è ciò che accade nella prima fase della sepsi dove, in conseguenza dell’aumentata estrazione, la quantità di ossigeno che giunge in vena cava superiore (e che è qui misurabile – ScvO2) risulta ridotta (fase iniziale della sepsi severa) (45, 46). Quando le alterazioni del microcircolo sono tanto avanzate da non consentire un’adeguata estrazione di ossigeno a livello tissutale (e, quindi, un altrettanto adeguato utilizzo a livello mitocondriale), la ScvO2 aumenta a valori superiori al normale, segnando l’inizio della fase di shock. La saturazione venosa di ossigeno è un parametro misurabile posizionando un catetere in vena cava inferiore o superiore con esclusione totale di tutto il sangue refluo dal seno coronarico; viene, quindi, escluso il monitoraggio dell’ossigenazione miocardica, (che può essere
effettuato inserendo un catetere di Swan Ganz in arteria polmonare), fondamentale nel paziente settico, arrivando a sovrastimare il vero stato di ossigenazione tissutale (47).
Un parametro misurabile in modo molto più facile e che consente di stimare adeguatamente lo stato di perfusione tissutale globalmente considerato è la concentrazione dei lattati. Questi tendono ad aumentare in ogni condizione di ipoperfusione tissutale e la clearance rappresenta un valido mezzo per comprendere l’evoluzione del quadro settico e la risposta ai trattamenti impostati, in quanto un loro aumento è considerato la conseguenza metabolica del ridotto apporto di O2 alle cellule e/o dell’incapacità di quest’ultime di utilizzarlo a livello mitocondriale (lattati superiori a 4 mmol/l) (48).
Qualunque sia la causa, il livello di lattato sierico è un forte indicatore prognostico di mortalità nel paziente settico;inoltre esso è indice di ipossiemia tissutale, precede le alterazioni dei parametri fisiopatologici e i suoi effetti sul microcircolo sono all’origine delle alterazioni d’organo che portano all’insufficienza multiorgano (MODS) e morte. Diversi studi hanno avvalorato il ruolo dei lattati nel predire l’outcome e nel guidare la terapia nella sepsi (49).
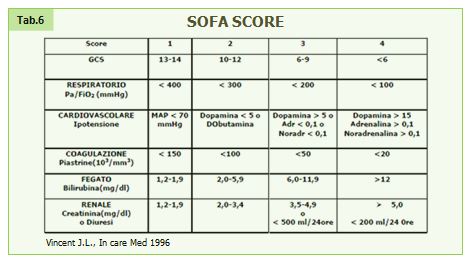
A livello clinico un punteggio ampiamente utilizzato per valutare la funzione d’organo è invece il SOFA score (Sepsis Organ Failure Assessment), con cui è possibile dare un punteggio da 1 a 4 ad ogni grado di insufficienza di 6 organi testati (neurologico, respiratorio, cardiovascolare, emocoagulativo, epatico, renale) (50).
Tabella 6. Sofa Score. Vincent J.L., In care Med 1996
I fattori prognosticamente sfavorevoli che causano un aumento dell’incidenza della sepsi risultano essere (51):
• Età avanzata
• Comorbidità
• Batteriemia
• Alto grado di isogravità
• Shock settico
• Sepsi severa
• Neutropenia severa
• Trattamento intempestivo e inadeguato
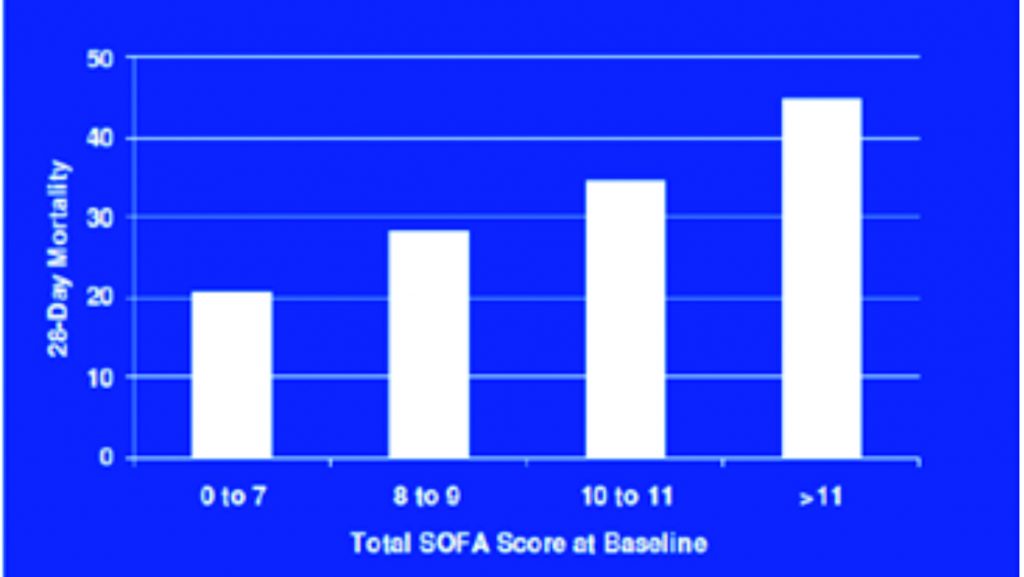
Figura 10. Mortalità in base al punteggio Sofa Score. Vincent J.L. Soap Study, In care Med 1996.
Ruolo dei biomarkers nelle infezioni
Negli ultimi anni sono stati effettuati numerosi studi per identificare un biomarker capace di identificare con certezza un’infezione, ma nonostante siano stati oggetto di studio diversi biomarkers, ad oggi non è stato identificato il marcatore ideale a causa del complesso quadro fisiopatologico della Sepsi (52).
Tra i marcatori studiati ricordiamo:
• La conta dei leucociti: marker aspecifico incapace di distinguere stati infiammatori sistemici da stati settici; non vi è relazione tra il loro incremento e la gravità della noxa o la sua persistenza (nelle fase avanzate di sepsi, infine, va ricordato lo sviluppo di una down regulation della risposta immunitaria sepsi mediata);
• I lattati: frutto della glicolisi anaerobia che si attiva negli stati di ipossia e ipoperfusione tissutale; la loro misurazione e la valutazione della loro clearance sono correlate con la prognosi e l’outcome dei pazienti con sepsi, con la severità di malattia, con la mortalità e con la risposta alla terapia (53, 54).
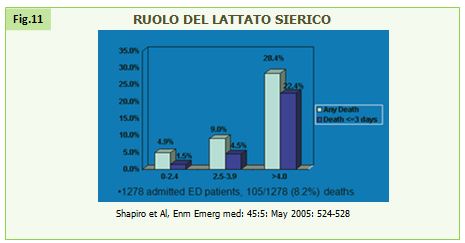
Un ruolo fondamentale, come già detto precedentemente, è il dosaggio dei lattati: esso permette di studiare il grado di ipoperfusione tissutale con la specificità simile alla misurazione della ScvO2 (55, 56). Inoltre nello studio di Shapiro è emerso che il tasso di mortalità (sia precoce che a 28 giorni) aumenta in maniera drammatica ed in stretta relazione con l’incremento dei lattati (57).
Figura 11. Ruolo del lattato sierico. Shapiro et al, Enm Emerg med: 45:5: May 2005: 524-528
L’importanza dei lattati deriva soprattutto dalla determinazione seriata di questi entro quattro ore, ovvero la cosiddetta clearance dei lattati; ciò è stato messo in evidenza dallo studio di Nguyen, dove pazienti con un’alta clearance di lattati entro sei ore di trattamento in DEA avevano la migliore sopravvivenza (58, 59, 60).
È corretto però ricordare come lo stesso Rivers sottolinei che non tutti i pazienti con sepsi severa hanno una lattacidemia aumentata. Ciò è stato evidenziato già nel 2003 da Levraut su “Critical Care Medicine” e successivamente confermato da altri studi, nei quali il 24% dei pazienti gravemente settici aveva una lattacidemia normale, introducendo così il concetto di alactemic sepsis (61, 62).
• PCR: pentaglobulina della fase acuta prodotta dal fegato; opsonina capace di legare la fosfocolina sulla parete dei batteri e di facilitarne la fagocitosi da parte dei macrofagi e di attivare la via classica del complemento; viene prodotta tra la quarta e l’ottava ora dopo l’insulto patogeno e presenta un picco di espressione
a 48 ore; i valori sierici normali variano da 5mg/l a 10mg/l; è una molecola sensibile, ma aspecifica, che si trova elevata sia in stati infiammatori sia infettivi indistintamente.
Nei diversi studi la sensibilità raggiunta è del 94,3% e la specificità di 87,3% (63, 64, 65).
• PCT: pro-ormone peptidico, senza attività endocrina, di produzione epatica e di altri tessuti non endocrini in risposta a noxae infettive; aumenta dopo la quarta ora e raggiunge il picco a 8-24 ore dalla noxa (in caso di sospetto clinico e bassi livelli di PCT è utile ripeterne il dosaggio almeno tra la sesta e la dodicesima ora dalla noxa); incrementa per infezioni batteriche (GRAM- > GRAM+); risulta non elevata in caso di infezioni virali, di batteri intracellulari o di infezioni localizzate; i livelli possono risentire della insufficienza renale (66, 67). La Procalcitonina, il cui ruolo diagnostico è stato alquanto ridimensionato poiché nella maggioranza dei casi i dati clinici sono sufficienti per eseguire una corretta diagnosi, ha ancora importanza per il ruolo prognostico e di guida al trattamento antibiotico, riducendo la quantità di antibiotici utilizzata (68, 69, 70, 71).
Tra i marcatori di recente scoperta riteniamo di segnalare:
• suPAR: forma solubile dell’uPAR (recettore di membrana implicato nel clivaggio e nell’attivazione del plasminogeno); non ha polimorfismi genici; si ottiene in circa due ore; è una molecola molto stabile anche se risente della emolisi del campione di sangue; il suo valore normale non supera i 4 ng/ml e presenta piccole differenze tra uomini e donne (72, 73).
• TREM1 (Triggering Receptor Expressed on Myeloid Cells 1): appartiene alla superfamiglia delle immunoglobuline, è espresso nelle cellule mieloidi (neutrofili e monociti maturi); amplifica la risposta infiammatoria acuta contro agenti microbici, agendo sinergicamente con altri recettori per prodotti microbici: Toll-likeReceptors (TLRs) ed Nod-likeReceptors (NLRs); viene prodotto e up-regolato, se vi è l’esposizione delle cellule mieloidi al LPS o altre componenti microbiche sia batteriche che fungine. TREM-1 è altamente espresso nei fagociti che si accumulano nelle zone infiammate, ma solo se l’infiammazione è causata da infezione fungina o batterica; non in quelle zone infiammate, ma non infette. Esiste una forma solubile (sTREM-1) dosabile nei liquidi biologici.
Livelli plasmatici di sTREM-1 superiori a 60 ng/ml sembrano essere più accurati di qualsiasi altro dato clinico o di laboratorio nell’identificare i pazienti con un’infezione in corso. Inoltre, la valutazione dei livelli plasmatici in corso di terapia per sepsi sembrerebbe avere un significato prognostico (74).
• PRESEPSINA: il sottotipo CD14 (sCD14-ST) è una forma troncata del CD14 solubile (sCD14) ed è costituito da 64 residui amminoacidici. Infiammazione sistemica e sepsi sono caratterizzate da un precoce aumento significativo della presepsina nel sangue e, quindi, questo piccolo polipeptide è stato proposto come un biomarker affidabile per la gestione della sepsi (75, 76).
In conclusione, l’utilizzo di singoli biomarkers è fondamentale solo se inserito in un contesto più ampio, che non può prescindere dalla clinica e dall’utilizzo di altri mezzi diagnostici.
Tabella 7. Resuscitation bundle. Rivers E. et al. N Engl J Med 2001; 345(19):1368-77 mod.
La logica comune e la letteratura scientifica sostengono attraverso molti argomenti che, nei PS in cui risulta difficoltoso eseguire un monitoraggio invasivo, l’uso della clearance del lattato è un sostituto della ScvO2 per valutare l’efficacia della terapia EGDT (82). Jones, su Chest 2010, ha evidenziato come principale conclusione del suo lavoro che l’obiettivo della normalizzazione della clearance dei lattati e l’obiettivo della normalizzazione della ScvO2, (parametro che conferma l’efficacia della terapia EGDT), non avevano differenza nell’outcome (83). La formula della clearence del lattato è:
Clearance lattato:
Lattato start – Lattato 2h/Lattato
start (%)
Una diminuzione della clearance del lattato del 10% o più in due ore è considerato pari al raggiungimento e/o mantenimento della ScvO2 >70% (84).
Nonostante le dovute precauzioni, ci sentiamo di consigliare l’uso della clearance del lattato come l’obiettivo più appropriato e di più semplice utilizzo da scegliere in caso di rianimazione precoce della sepsi negli ospedali dove risulta difficoltosa l’introduzione di un catetere venoso.
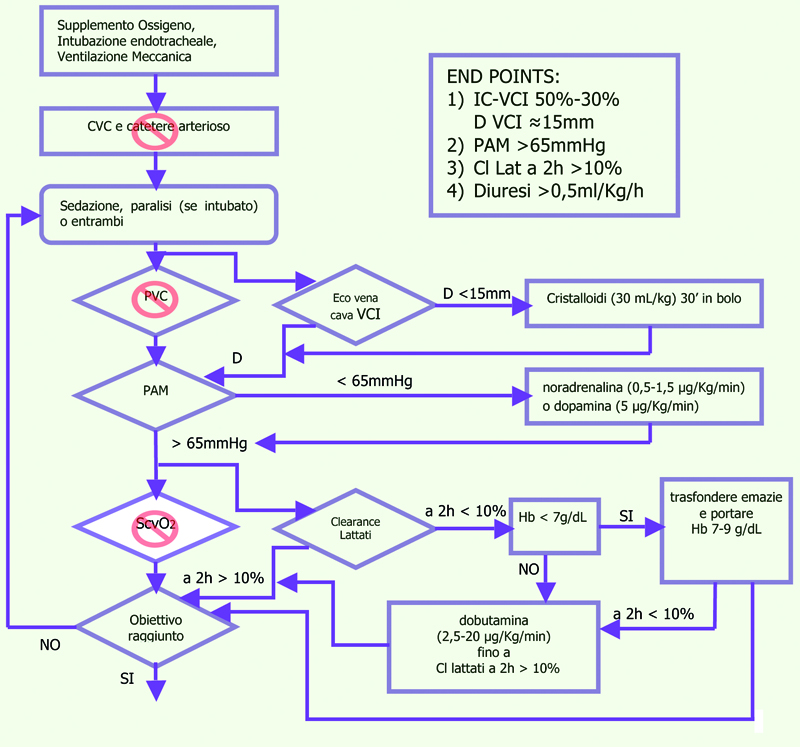
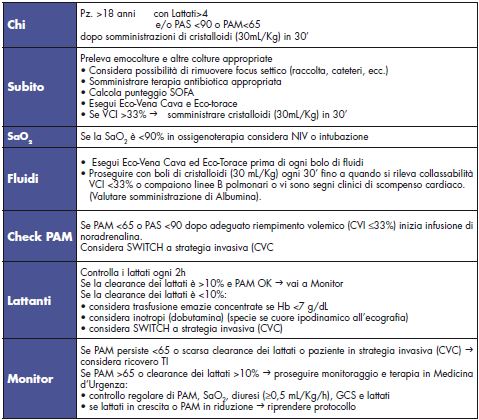
In conclusione si può quindi affermare che, allo stato attuale, nel paziente settico, che sia ancora in Pronto Soccorso o ricoverato in Medicina d’Urgenza o in Reparto di Medicina Interna, le certezze derivano da metodiche non invasive: ecografia (VCI, torace, cuore) e clearance dei lattati.
Tabella 8. Protocollo non invasivo.
Protocollo non invasivo. La nostra proposta Azienda USL Umbria 1.
De Backer et al. confermano che l’utilizzo della Noradrenalina riduce la mortalità del paziente settico rispetto all’utilizzo della Dopamina (85).
L’Adrenalina viene considerata come possibile agente vasopressore, agendo come β-agonista da aggiungere alla Noradrenalina o Dopamina in caso di ipotensione refrattaria, anche se questa è in grado di provocare un aumento del metabolismo cellulare e quindi di peggiorare le condizioni di anaerobiosi, aumentando di conseguenza la produzione lattati.
Il dosaggio consigliato è 0,1-0,5 μg/Kg/min (86). L’utilizzo degli Steroidi nella sepsi è tuttora oggetto di discussione poiché diversi studi non hanno evidenziato beneficio nella somministrazione degli stessi (87, 88). D’altro canto uno studio recente ha evidenziato che l’impiego di steroidi a dosi ‘fisiologiche’ può ridurre la mortalità di pazienti con shock settico refrattario, per i quali è necessario l’impiego di vasopressori e della ventilazione meccanica prolungata (89).
Ad oggi è consigliabile valutare la somministrazione di un breve ciclo (da 7 a 10 gg.) di basse dosi di Idrocortisone (200 mg/die) in pazienti vasopressori dipendenti (dosaggio di noradrenalina o equivalente superiore a 0,1 mg/kg/minuto) entro 12 ore dalla comparsa di shock (90).
Questa strategia sembra diminuire la dipendenza dai farmaci vasopressori e non aumenta la mortalità o il rischio di superinfezioni (91, 92).
Gli steroidi devono essere interrotti nei pazienti la cui dipendenza dai vasopressori non sia migliorata dopo due giorni di trattamento steroideo (93).
Negli ultimi anni numerosi studi hanno evidenziato come l’uso di soluzioni contenti Albumina per la rianimazione dei pazienti con sepsi sia associata ad una più bassa mortalità rispetto ad altri regimi rianimazione fluidi (94, 95, 96, 97).
Lo studio italiano Albios (Albumin Italian Oucome Sepsis Study 2012) riporta che il dosaggio di Albumina utilizzato in sostituzione delle soluzioni cristalloidi era di 60 gr in infusione e 40-60 gr giornalmente, per mantenere il livello di albumina intorno ai 30 gr/lt (98).
Nei pazienti con sepsi severa è consigliabile somministrare in maniera profilattica sacche di piastrine quando la conta di esse è <10.000 mm3 in assenza di sanguinamenti o quando la conta è <20.000 mm3 se il paziente ha una alto rischio di sanguinamento (99, 100).
Nei pazienti chirurgici (SICU) è stato evidenziato da Hermans nel 2007 che mantenere i livelli di glicemia compresi tra 80 e 110 mg/dL si associa ad una minore morbilità e mortalità (mortalità per batteriemia 12.5% vs 29.5% nei pazienti sotto stretto controllo glicemico rispetto ai controlli). Nei pazienti medici (MICU) mantenere un livello di glucosio tra 80-110 mg/dL ha benefici solo dopo cinque giorni nel gruppo in cui si è agito in maniera più aggressiva (inferiore a tre giorni vi è un aumento della mortalità) (101). I nuovi studi evidenziano l’aumento della mortalità a tre mesi nel gruppo di pazienti mantenuti con target glicemico tra 80 e 108 mg/dl rispetto al gruppo di pazienti mantenuto con target glicemico inferiore ai 180 mg/dl (102). Di conseguenza l’obiettivo da raggiungere nei pazienti settici è ottenere un valore glicemico <180 mg/dl. È consigliabile monitorizzare la glicemia, attraverso prelievo venoso, frequentemente dopo l’inizio dell’infusione, da protocollo ogni 30’-60’ e regolarmente ogni 4 ore, finché la glicemia non è stabilizzata.
In pazienti con sepsi severa va effettuata profilassi per TVP con eparina a basso peso molecolare (103).
Nel 2011 a seguito dello studio Prowess-shock pubblicato su Intensive Care Medicine, la casa farmaceutica produttrice dello Xigris ha deciso il ritiro del farmaco a causa dell’assenza di risultati favorevoli (104, 105).
Trattamento antibiotico
È oramai certo che i pazienti che ricevono l’antibiotico-terapia nelle primissime ore dalla valutazione in triage hanno un maggior tasso di sopravvivenza (106). Ogni ora di ritardo dell’inizio della terapia antibiotica in pazienti con ipotensione determina un aumento della mortalità dell’8% (107); per tale motivo non si deve attendere il ricovero del paziente settico, ma deve essere iniziata entro tre ore (entro un’ora in caso di sepsi severa o shock) la terapia antibiotica, ragionata in base alla sede sospetta d’infezione e agli studi epidemiologici della flora locale.
La scelta empirica degli antibiotici dipende da complesse problematiche legate all’anamnesi del paziente (incluse eventuali intolleranze a farmaci), alle comorbidità, alla sindrome clinica ed al tipo di resistenze possedute dai microrganismi presenti nella comunità, nell’ospedale od in altre strutture sanitarie.
La scelta iniziale di un regime antimicrobico empirico dovrebbe mirare ad uno spettro abbastanza ampio di patogeni, seguendo i suddetti criteri e agendo su tutti i micro-organismi possibili, poiché il margine d’errore ammissibile nel trattamento dei pazienti critici è molto piccolo. Per contro, non iniziare prontamente una terapia antibiotica appropriata (per esempio una terapia che sia attiva contro l’agente causale patogeno) ha effetti estremamente negativi sulla prognosi della malattia, secondo i dati tratti dall’evidenza (108, 109, 110, 111).
Kumar su Chest nel 2009 evidenziò che il 20% dei pazienti non riceveva l’antibiotico ‘giusto’ e che in questi casi la sopravvivenza si riduceva di cinque volte (con un aumento di quasi il 50% nella mortalità, se non trattato entro le sei ore) (112, 113).
Tutti i pazienti dovrebbero ricevere una dose piena di carico per ciascun antibiotico. Tuttavia, i pazienti con sepsi severa o con shock settico spesso hanno una funzione renale o epatica ridotta e possono avere alterati volumi di distribuzione dovuti all’aggressiva rianimazione con i fluidi (114, 115, 116).
La riduzione del numero degli antibiotici ed il restringimento dello spettro della terapia antibiotica rappresentano una strategia importante, da attuare al fine di limitare lo sviluppo di patogeni resistenti ed al fine di controllare i costi (terapia mirata); infatti, una volta identificato l’agente eziologico, non esiste alcuna evidenza che la terapia antibiotica combinata sia più efficace della monoterapia e, in ogni caso, bisogna effettuare una de-escalation therapy non oltre il quinto giorno di terapia (117).
Normalmente in assenza di fattori di rischio la terapia durerà 7-10 giorni, mentre in caso di fattori di rischio come neutropenia, immunodeficienza, foci difficilmente drenabili o una risposta clinica lenta, la terapia può proseguire oltre il decimo giorno (118). L’uso pre-ospedaliero degli antibiotici nella sepsi, sebbene abbia un suo fondamento razionale, al momento non è ancora supportato da studi clinici randomizzati (119).
È preferibile che il trattamento antibiotico avvenga attraverso una porta vascolare supplementare (120). La terapia antimicrobica empirica deve includere uno o più farmaci che abbiano attività contro tutti i possibili agenti (batteri, funghi e/o virus). Un ruolo fondamentale è il tener conto dei dati epidemiologici locali, la resistenza di bacilli GRAM- ai β-lattamici ed ai carbapenemici in alcune comunità e Staphylococcus aureus Meticillino resistente o Vancomicino-resistente.
Nei pazienti con fattori di rischio (immunosoppressione, neutropenia, recente terapia antibiotica intensa) dobbiamo considerare una terapia anti-funginea (Fluconazolo) (121).
Nella sepsi da batteri GRAM- non esiste superiorità scientificamente provata della politerapia rispetto la ionoterapia, ad eccezione dell’infezione da Pseudomodas aeruginosa, che invece prevede l’utilizzo di terapia associata (122, 123).
La più alta probabilità di avere emocolture positive dipende dal contesto clinico; ad esempio, nel paziente con shock settico, emocolture positive si aggirano intorno al 69%, riducendosi progressivamente in pazienti con sepsi severa o sepsi (124).
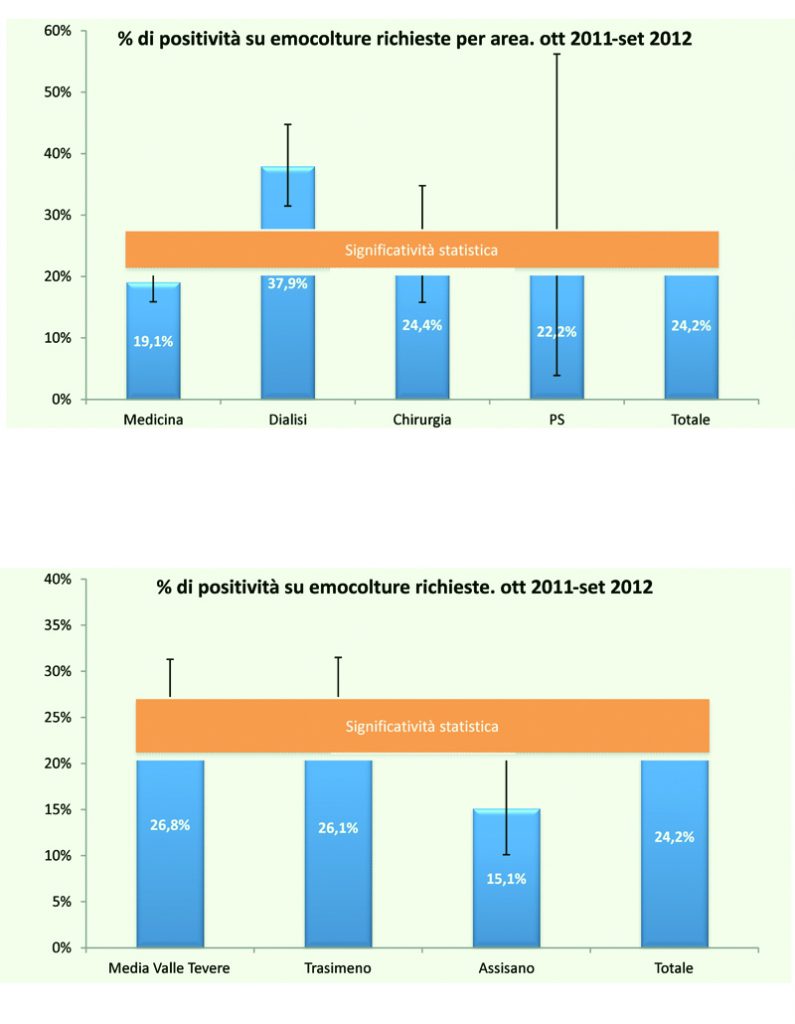
Dallo studio delle emocolture che sono state eseguite nel corso di 13 mesi nell’ex territorio AUSL Umbria 2, che coinvolgeva gli ospedali di Assisi, Media Tevere Valle e Castiglione del Lago (Ott.2011-Sett.2012) abbiamo evidenziato i seguenti risultati:
Emocolture eseguite nei Pronti Soccorsi, Reparti e Dialisi dell’ex AUSL Umbria 2
Tabella 9. Emocolture eseguite nel periodo Ott.2010-Set.2011 = 836; la differenza non è statisticamente significativa; l’intervallo di confidenza al 95% nei reparti di Pronto Soccorso risulta essere assai ampio per il ridotto numero di emocolture eseguite in PS.
Tabella 10. La positività più bassa viene registrata nell’ospedale di Assisi. Tale differenza risulta statisticamente significativa rispetto alla media generale.
Tabella 11. È possibile evidenziare una lieve prevalenza di positività tra le Femmine vs Maschi, seppur non statisticamente significativa.
Tabella 12. In accordo con la letteratura internazionale
vi è una prevalenza di GRAM+ rispetto
ad i GRAM- nei pazienti a cui sono state
effettuate il prelievo per emocoltura; il riscontro
di miceti è molto basso.
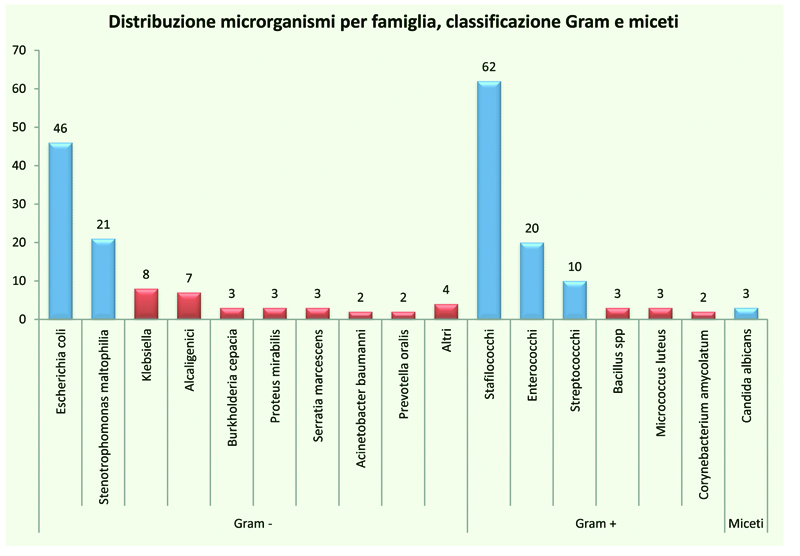
Tabella 13. La distribuzione
delle positività per microrganismo
fa registrare una netta
prevalenza di E. coli,
S. maltophilia tra i
Gram- e di Stafiloccocchi,
Enterococchi
e Streptococchi tra i
Gram+. Le emocolture
positive per miceti
sono poche.
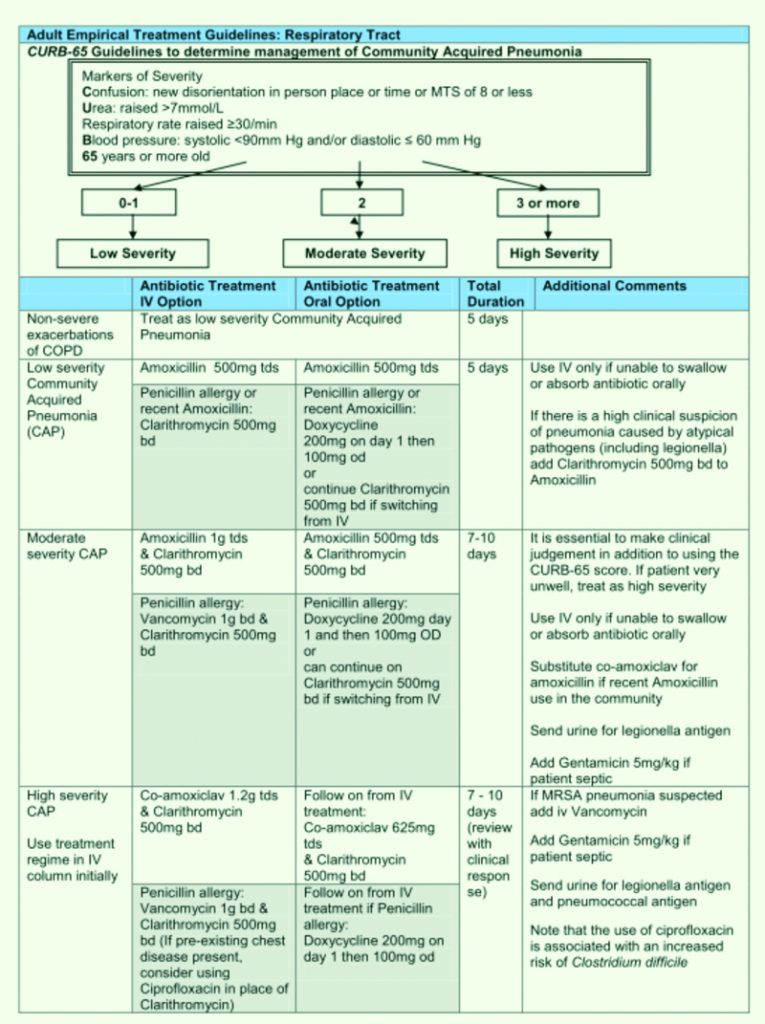
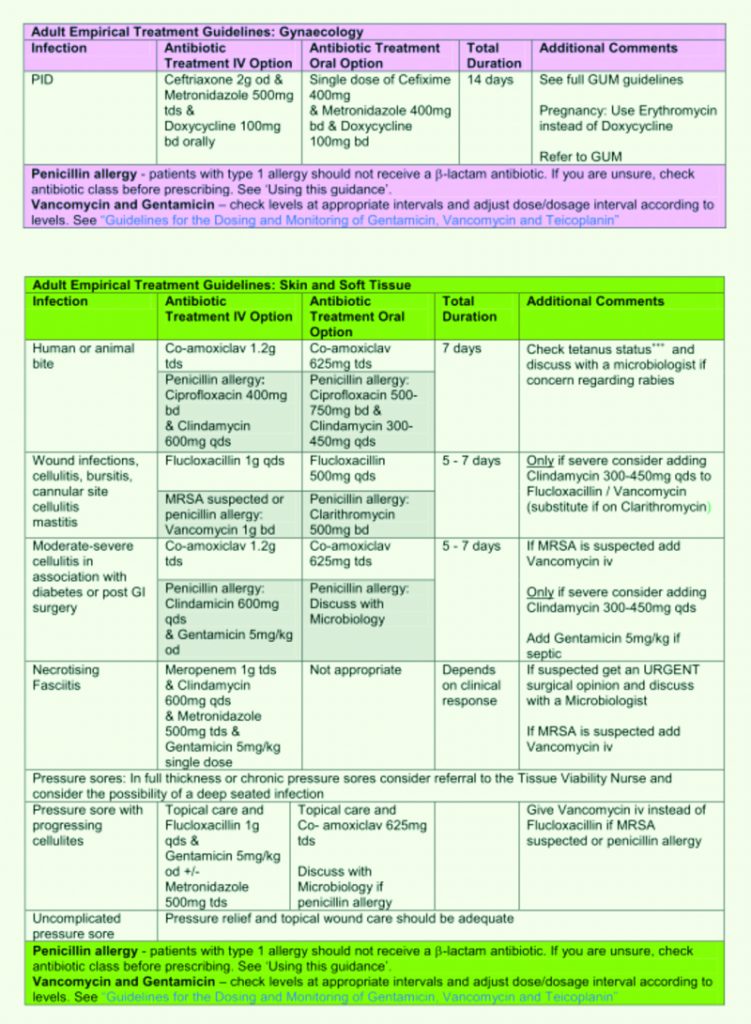
Tabella 14. Linee Guida al trattamento antibiotico empirico. Royal United Hospital Bath NHS Trust. Guidelines for the Empirical Treatment of Infections in Adults.August 2010.
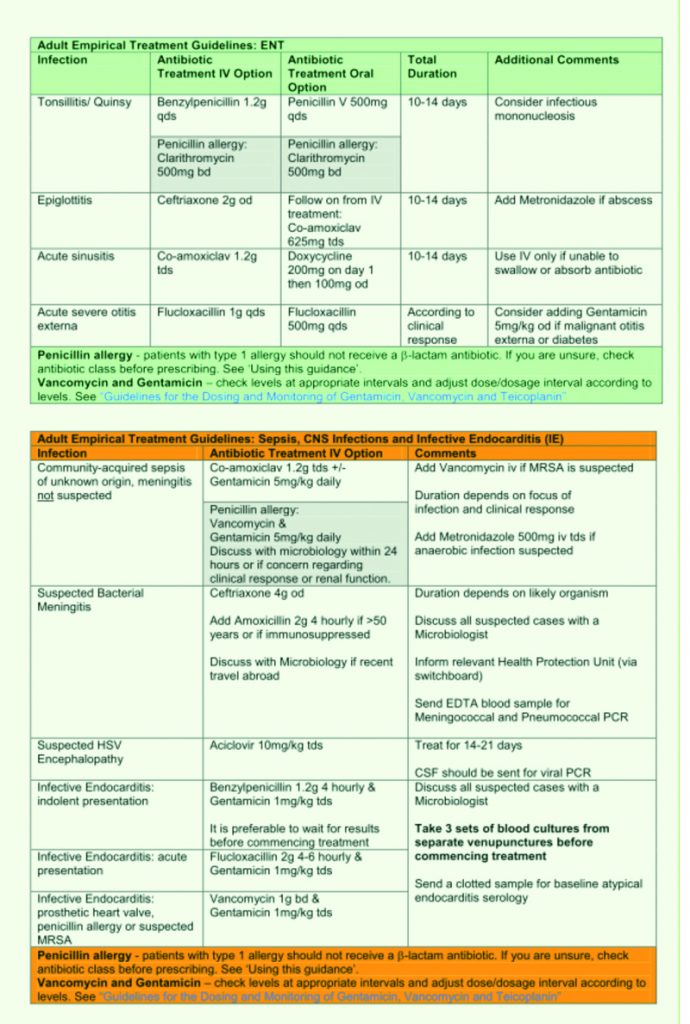
Tabella 15. Linee Guida al trattamento antibiotico empirico.
Royal United Hospital Bath NHS Trust. Guidelines for the Empirical Treatment of Infections in Adults.August 2010.
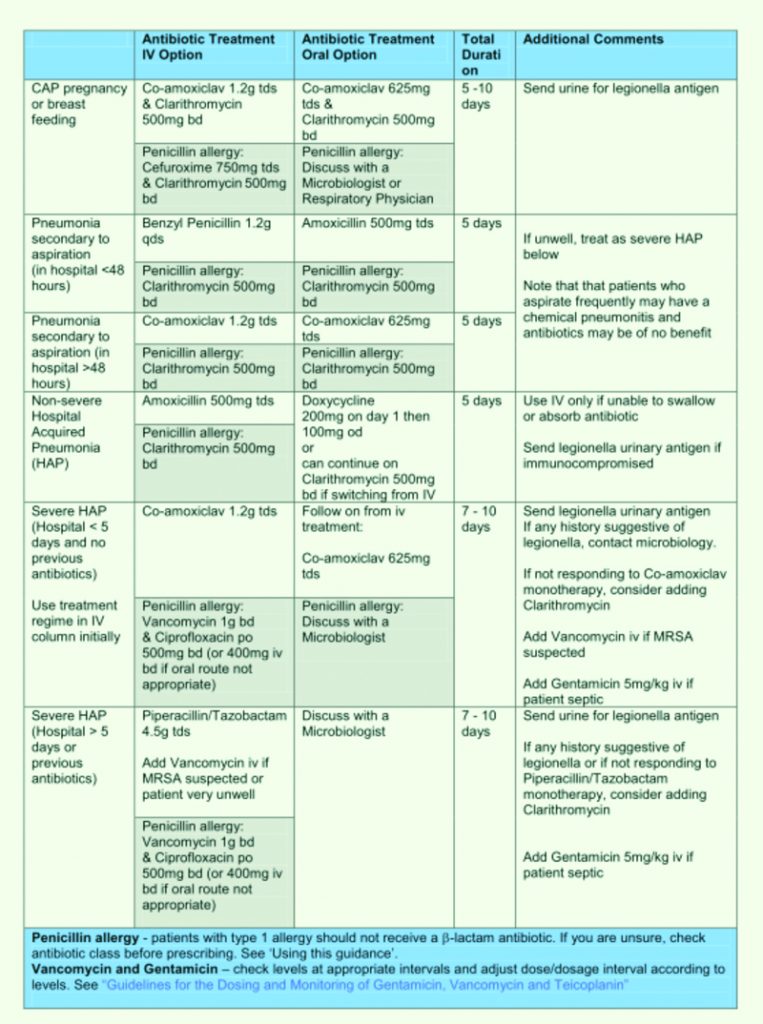
Tabella 16. Linee Guida al trattamento antibiotico empirico. Royal United Hospital Bath NHS Trust. Guidelines for the Empirical Treatment of Infections in Adults.
August 2010.
Tabella 17. Linee Guida al trattamento antibiotico empirico.
Royal United Hospital Bath NHS Trust. Guidelines for the Empirical Treatment of Infections in Adults, August 2010.
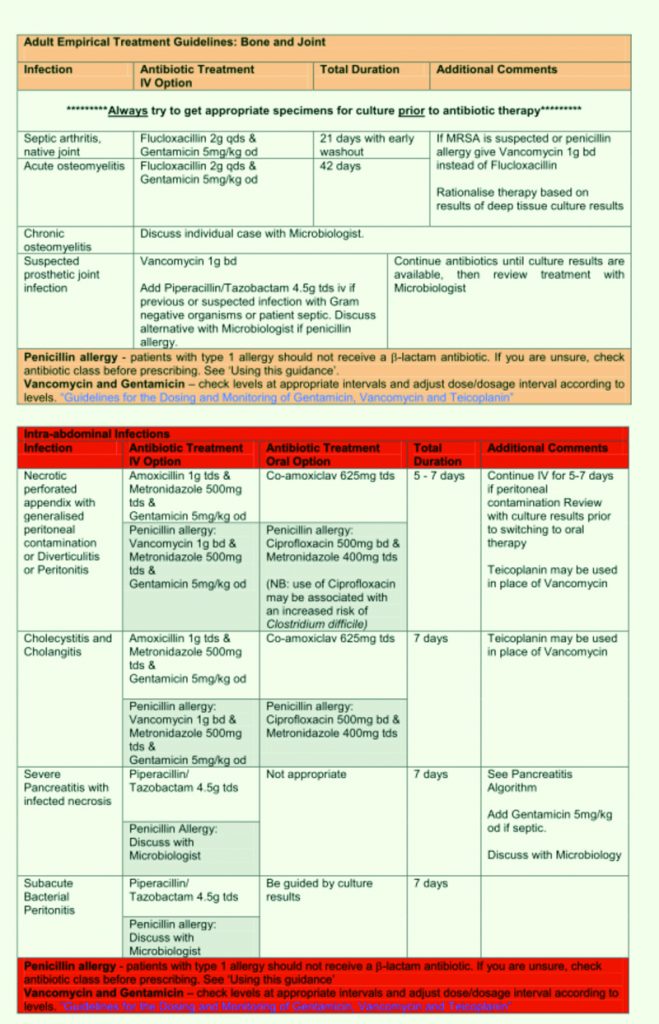
Tabella 18. Linee Guida al trattamento antibiotico empirico. Royal United Hospital Bath NHS Trust. Guidelines for the Empirical Treatment of Infections in Adults.
August 2010.
Tabella 19. Linee Guida al trattamento antibiotico empirico.
Royal United Hospital Bath NHS Trust. Guidelines for the Empirical Treatment of Infections in Adults, August 2010.
Tabella 20. Protocollo non invasivo sepsi grave in PS.
Riassunto sul Protocollo non invasivo per la gestione del paziente con sepsi nei PS/DEA AUSL Umbria 1.
Bibliografia
1. Levy MM, Fink MP, Marshall JC, Abraham E, Angus D, Cook D, Cohen J, Opal SM, Vincent JL, Ramsay G. International Sepsis Definitions Conference. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Defi nitions Confe- Definitions Conference. Intensive Care Med. 2003; 29 (4): 530-8.
2. Dellinger RP, International Surviving Sepsis Campaign Guidelines Committee. Surviving Sepsis Campaign. International guidelines for management of severe sepsis and septic shock: 2008. Crit Care Med. 2008; 36 (1): 296-327.
3. Jones AE, Trzeciak S, Dellinger RP. Arterial pressure optimization in the treatment of septic shock: a complex puzzle. Critical care 2010; 14:102.
4. Weighardt H, Holzmann B. Role of Toll-like receptor responses for sepsis pathogenesis. Immunobiology. 2008; 212: 715-722.
5. Marshall JC, Charbonney E, Gonzalez PD. The immune system in critical illness. Clin Chest Med. 2008; 29 (4): 605-16.
6. Hauser B, Radermacher P. Right man, right time, right place? On the time course of the mediator orchestra in septic shock. Critical Care. 2010; 14 (4): 180.
7. Alloatti G, Fisiologia dell’uomo, cap.17 “Controllo nervoso e umorale del sistema cardiocircolatorio”, edizione 2002, Edi. Ermes.
8. Alves-Filho JC, Benjamim C, Tavares-Murta BM, Cunha FQ. Failure of neutrophil migration toward infectious focus in severe sepsis: a critical event for the outcome of this syndrome. Mem Inst Oswaldo Cruz. 2005; Vol.100 (Suppl. I): 223-226.
9. Rios-Santos F, Alves-Filho JC, Souto FB et al. Downregulation of CXCR2 on Neutrophils in Severe Sepsis Is Mediated by Inducible Nitric Oxide Synthase–derived Nitric Oxide. Am J Respir Crit Care Med. 2007; 175: 490–497.
10. Torres-Duen D, Celes MRN, Freitas A, Alves-Filho JC et al. Peroxynitrite mediates the failure of neutrophil migration in severe polymicrobial sepsis in mice. British Journal of Pharmacology. 2007; 152: 341–352.
11. Whiteman M, Halliwell B. Protection against peroxynitritedependent tyrosine nitration and alpha 1-antiproteinase inactivation by ascorbic acid. A comparison with other biological antioxidants. Free Radic Res. 1996. 25: 275–283.
12. Hartemink KJ, Paul MA, Spijkstra JJ, Girbes ARJ and Polderman KH. Immunoparalisis as a cause for invasive aspergillosis? Intensive Care Med. 2003; 29: 2068-2071.
13. Von Müller LA, Klemm M, Weiss M et al. Active cytomegalovirus infection in patients with septic shock. Emerg Infect Dis. 2006; 12: 1517-22.
14. Annane D, Bellissant E, Cavaillon JM. Septic shock; Lancet. 2005; 365:63-78.
15. Munford RS, Pugin J. Normal responses to injury prevent systemic inflammation and can be immunosuppressive. Am. J. Respir. Crit. Care. Med. 2001; 163: 316-321.
16. Faist E, Schinkel C, Zimmer S. Update on the mechanisms of immune suppression of injury and immune modulation. World J Surg. 1996; 20 (4): 454-9.
17. Faist E, Schinkel C, Zimmer S. Update on the mechanisms of immune suppression of injury and immune modulation. World J Surg. 1996; 20 (4): 454-9.
18. Rivers EP et al. Early biomarker activity in severe sepsis and septic shock and a contemporary review of immunotherapy trials: not a time to give up, but to give it earlier, Shock. 2013; 39: 127-137.
19. Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, Schein RM, Sibbald W. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest. 1992; 101 (6): 1644-55.
20. Martin GS, Mannino DM, Eaton S, Moss M. The Epidemiology of Sepsis in the United States from 1979 through 2000, M.D. N Engl J Med. 2003; 348: 1546-1554.
21. Vincent JL, Sakr Y, Sprung CL, Ranieri VM, et al. Sepsis in European intensive care units: results of the SOAP study. Sepsis Occurrence in Acutely Ill Patients Investigators. Crit Care Med. 2006; 34 (2): 344-53.
22. Vincent JL, Sakr Y, Sprung CL, Ranieri VM, et al. Sepsis in European intensive care units: results of the SOAP study. Sepsis Occurrence in Acutely Ill Patients Investigators. Crit Care Med. 2006; 34 (2): 344-53.
23. Djillali Annane et al. Current Epidemiology of Septic Shock Am. J. Respir. Crit. Care Med. 2003; 168: 165-172. 24. Valles J, Rello J, Ochagavia A, et al. Community-acquired bloodstream infection in critically ill adult patients: impact of shock and inappropriate antibiotic therapy on survival. Chest. 2003; 123: 1615-1624.
25. Boussekey N, Cantrel J, Debrabant LJ, et al. Epidemiology, Prognosis, and Evolution of Management of Septic Shock in a French Intensive Care Unit. A Five Years Survey. 2010; 2010: 436427.
26. Salvo L. et al. The Italian sepsis study: preliminary results on the incidence and evolution of SIRS, sepsis, severe sepsis and septic shock. Intensive Care Medicine. 1995; 21: S244-S249.
27. Dati Regione Toscana 2012.
28. Padkin A, Goldfrad C, Brady AR, et al. Epidemiology of severe sepsis occurring in the first 24 hours in intensive care units in England, Wales and Northern Ireland. Crit Care Med. 2003; 31(9): 2332-2338.
29. Danai PA, Moss M, Mannino DM, Martin GS. The epidemiology of sepsis in patients with malignancy. Chest. 2006; 129: 1432-1440.
30. Kumar A. Optimizing antimicrobial therapy in sepsis and septic shock. Crit Care Clin. 2009; 25 (4): 733-751.
31. Padkin A, Goldfrad C, Brady AR, et al. Epidemiology of severe sepsis occurring in the first 24 hours in intensive care units in England, Wales and Northern Ireland. Crit Care Med. 2003; 31 (9): 2332–2338.
32. Dellinger RP, Carlet JM, Mansur H, et al. Surviving Sepsis Campaign guidelines for the management of severe sepsis and septic shock. Crit Care Med. 2004; 32 (3): 858–873.
33. Monti M, Filippucci M, Vincentelli GM. La Golden Hour della sepsi. Prevention and Research. 2012; Supplement 2: 2-4.
34. Dellinger RP et al. Surviving Sepsis Campaign: international guidelines for the management of severe sepsis and septic shock. Crit Care Med. 2008; 36: 296-327.
35. Rivers EP, Nguyan B, Huang DT, et al. Early goal directed therapy. Crit Care Med. 2004; 32 (1): 314-315.
36. Kumar A. et Al. Duration of hypotension prior to initiation of effective antimiocorobyal therapy is the critical determinant of survival in human septic shock, Crit. Care Med. 2006; 34: 1589-1596.
37. Dellinger RP, Vincent JL. The Surviving Sepsis Campaign sepsis change bundles and clinical practice Critical Care. 2005, 9: 653-654.
38. Rivers EP, Nguyan B, Huang DT, et al. Early goal directed therapy. Crit Care Med. 2004; 32 (1): 314-315.
39. Levy MM, Fink MP, Marshall JC, Abraham E, Angus D, Cook D, et al. SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Crit Care Med. 2003; 31: 1250–1256.
40. Chen Y-C, Jenq C-C, Tian Y-C, Chang MY, Lin CY, Chang CC, et al. Rifle classification for predicting in-hospital mortality in critically ill sepsis patients. Shock. 2009; 31: 139-145.
41. Seam N, Suffredini AF. Mechanisms of sepsis and insights into clinical trials. Drug Discov Today Dis Mech. 2007; 4: 83–93.
42. Vieillard-Baron A, Prin S, Chergui K, Dubourg O, Jardin F. Hemodynamic instability in sepsis: bedside assessment by Doppler echocardiography. Am J Resp Crit Care. 2003; 168: 1270-6.
43. Fields JM, Lee PA, Jenq KY, Mark DG, Panebianco NL,. Dean AJ. The Interrater Reliability of Inferior Vena Cava. Ultrasound by Bedside Clinician, Academic Emergency Medicine. 2011; 18: 98-101.
44. Wiedemann HP, Wheeler AP, Bernard GR. et al. Comparison of two fluid-management strategies in acute lung injury. N Engl J Med. 2006 Jun 15; 354 (24): 2564.
45. Rivers, EP, et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med. 2001; 345 (19): 1368-77.
46. Reinhart, K, et al. Continuous central venous and pulmonary artery oxygen saturation monitoring in the critically ill. Intensive Care Med. 2004; 30 (8): 1572-8.
47. Rivers, EP, et al. Central venous oxygen saturation monitoring in the critically ill patient. Curr Opin Crit Care. 2001; 7 (3): 204-11.
48. Jones et al. Lactate clearance vs Central Venouse Oxygen Saturation As goals of early sepsis therapy: a randomimized clinical trial, JAMA. 2010; 303 (8): 739-746.
49. Bakker J, Jansen TC. The prognostic value of blood lactate levels relative to that of vital signs in the pre-hospital setting, Critical Care. 2008; 12: R160.
50. Vincent JL, De Mendonça A, Cantraine F, Moreno R, Takala J, Suter PM, Sprung CL, Colardyn F, Blecher S. Use of the SOFA score to assess the incidence of organ dysfunction/failure in intensive care units: results of a multicenter, prospective study. Working group on “sepsis-related problems” of the European Society of Intensive Care Medicine. Crit Care Med. 1998 Nov; 26 (11): 1793-800.
51.Puskarich MA, Marchick MR, Kline JA, Steuerwald MT, Jones AE. One year mortality of patients treated with an emergency department based early goal directed therapy protocol for severe sepsis and septic shock: a before and after study. Crit Care. 2009; 13 (5).
52. Vincent JL. Sepsis biomarkers: a review. Charalampos Pierakos. Critil Care. 2010; 14: R15.
53. Nguyen HB, Rivers EP. Early lactate clearance is associated with improved outcome in severe sepsis and septic shock. Critical Care Medicine. 2004; 32 (8): 1637–1642.
54. Bakker J, Jansen TC. Don’t take vitals, take a lactate. Intensive Care Medicine. 2007; 33 (11): 1863–1865.
55. Bellomo R, Reade MC. The pursuit of a high central venous oxygen saturation in sepsis: growing concerns. Critical Care. 2008; 12 (2): 130.
55. Jones AE, Shapiro NI, Trzeciak S, Arnold RC, Claremont HA, Kline JA. Lactate clearance vs central venous oxygen saturation as goals of early sepsis therapy: a randomized clinical trial. Emergency Medicine Shock Research Network (EMShockNet) Investigator. JAMA. 2010; 303 (8): 739-46.
56. Shapiro NI, Howell MD, Talmor D, et al. Serum lactate as a predictor of mortality in emergency department patients with infection. Ann Emerg Med. 2005; 45 (5): 524-528.
57. Nguyen HB, Rivers EP. Early lactate clearance is associated with improved outcome in severe sepsis and septic shock. Critical Care Medicine. 2004; 32(8): 1637–1642.
58. Salluh JI, Povoa P. Biomarkers as end points in clinical trials of severe sepsis: a garden of forking paths. Crit Care Med. 2010, 38m (8): 1685-1694.
58. Anderson R, Schmidt R. Clinical biomarkers in sepsis. Front Biosci. 2010; 2: 504-520.
59. Levraut J, Ichai C, Petit I, Ciebiera JP, Perus O, Grimaud D. Low exogenous lactate clearance as an early predictor of mortality in normolactatemic critically ill septic patients. Crit Care Med. 2003; 31 (3): 705-10.
60. Cannon CM, S, Septic Shock Collaborative for the Multicenter Severe. The GENESIS Project (GENeralization of Early Sepsis InterventionS). A Multicenter Quality Improvement Collaborative. Acad Emerg Med. 2010; 17: 1258.
61. Tsalik El, Jaggers LB, Glickman SW, at al. Discriminative value of inflammatory Biomarkers for suspected sepsis. Jemerg Med. 2012; 43 (1): 97-106.
61. Van der Meer V, Neven AK, Van den Broek P et al. Diagnostic value of C reactive protein in infections of the lower respiratory tract: systematic review. BMJ. 2005; 331: 26.
62. Luna CM. C-Reactive Protein in Pneumonia: Let Me Try Again. Chest. 2004; 125: 1192-1195.
63. Tang BM, Eslick GD, Craig JC, McLean AS. Accuracy of procalcitonin for sepsis diagnosis in critically ill patients: systematic review and meta-analysis. Lancet Infect Dis. 2007; 7 (3): 210-217.
64. Jensen JU, Heslet L, Jensen TH, et al. Procalcitonin increase in early identification of critically ill patients at high risk of mortality. Crit Care Med. 2006; 34 (10): 2596-2602.
65. Becker KL, Snider R, and Nylen ES. Procalcitonin in sepsis and systemic inflammation: a harmful biomarker and a therapeutic target. Br J Pharmacol. 2010 Jan; 159 (2): 253–264.
66. Uzzan B, Cohen R, Nicolas P, et al. Procalcitonin as a diagnostic test for sepsis in critically ill adults and after surgery or trauma: a systematic review and meta-analysis. Again Crit Care Med. 2006; 34 (7): 1996-2003.
67. Tang BM, Eslick GD, Craig JC, McLean AS. Accuracy of procalcitonin for sepsis diagnosis in critically ill patients: systematic review and meta-analysis. Lancet Infect Dis. 2007; 7 (3): 210-217.
68. Kibe S, Adams K, Barlow G. Diagnostic and prognostic biomarkers of sepsis in critical care. J AntimicrobChemother. 2011; 66 Suppl 2: 1133-1140.
68. Koch, Voigt S, Kruschinski C et al. Circulating soluble urokinase plasminogen activator receptor is stably elevated during the first week of treatment in the intensive care unit and predicts mortality in critically ill patients. Critical Care. 2011; 15: R63.
69. Kristian K, Jesper Eugen-Olsen, at al. Use of plasma C-reactive protein, procalcitonin, neutrophils, macrophage migration inhibitory factor, soluble urokinase-typeplasminogen activator receptor, and soluble triggering receptor expressed on myeloid cells-1 in combination to diagnose infections: a prospective study. Critical Care. 2007; 11.
70. Ford JW, McVicar DW. TREM and TREM-like receptors in inflammation and disease. Curr Opin Immunol 2009; 21(1):38-46.
71. Shozushima T, Takahashi G, Matsumoto N, Kojika M, Okamura Y, Endo S. Usefulness of presepsin (sCD14-ST)
measurements as a marker for the diagnosis and severity of sepsis that satisfied diagnostic criteria of systemic inflammatory response syndrome. J Infect Chemother. 2011 Dec; 17 (6): 764-9.
72. Palmiere C, Mussap M, Bardy D, Cibecchini F, Mangin P.Diagnostic value of soluble CD14 subtype (sCD14-ST) presepsin for the postmortem diagnosis of sepsis-related fatalities. Int J Legal Med. 2012 Dec 22.
73. Dellinger RP, Carlet JM, Mansur H, et al. Surviving Sepsis Campaign guidelines for the management of severe sepsis and septic shock. Crit Care Med. 2004; 32 (3): 858–873.
74. Annane D, et al. Septic shock, Septic shock—diagnosis and treatment, Lancet. 2005; 365: 63-78.
75. Dellinger RP, Levy MM, Rhodes A et al. Surviving Sepsis Campaign guidelines for the management of severe sepsis and septic shock 2012. Crit Care Journal. 2013; 41 n.2.
76. Dellinger RP, Levy MM, Rhodes A et al. Surviving Sepsis Campaign guidelines for the management of severe sepsis and septic shock 2012. Crit Care Journal. 2013; 41 n.2.
77. Dellinger RP, Levy MM, Rhodes A et al. Surviving Sepsis Campaign guidelines for the management of severe sepsis and septic shock. 2012. Crit Care Journal. 2013; 41 n.2.
78. Alan E. Jones et al. For the Emergency Medicine Shock Research Network (EMShockNet) Investigators. Lactate Clearance vs Central Venous Oxygen Saturation as Goals of Early Sepsis Therapy: a Randomized Clinical Trial. JAMA. 2010; 303 (8): 739-746.
79. Point J. Should Lactate Clearance Be Substituted for Central Venous Oxygen saturation as Goals of Early Severe Sepsis and Septic Shock Therapy. Yes. Chest. 2011; 140 (6): 1406-1408.
80. Point J. Should Lactate Clearance Be Substituted for Central Venous Oxygen saturation as Goals of Early Severe Sepsis and Septic Shock Therapy. Yes. Chest. 2011; 140 (6): 1406-1408.
81. De Backer D, Aldecoa C, Njimi H, Vincent JL. Dopamine versus norepinephrine in the treatment of septic shock: a meta-analysis. Crit Care Med. 2012; 40 (3): 725-730.
82. Dellinger RP, Carlet JM, Mansur H, et al. Surviving Sepsis Campaign guidelines for the management of severe sepsis and septic shock. Crit Care Med. 2004; 32 (3): 858–873.
83. Sprung CL, Annane D, Singer M, et al. CORTICUS Study Group. Crit Care. 2011; 15 (5): 446.
84. Annane D, Cariou A, Maxime V et al. COIITSS Study Investigators, Corticosteroid treatment and intensive insulin therapy for septic shock in adults: a randomized controlled trial. JAMA. 2010; 303 (4): 341-348.
85. Marik PE. Critical illness related corticosteroid insufficiency. Chest. 2009; 135: 181-193.
86. Marik PE. Critical illness related corticosteroid insufficiency. Chest. 2009; 135: 181-193.
87. Beale R, Janes JM, Brunkhorst FM, Dobb G, Levy MM, Martin GS, Ramsey G, Silva E, Sprung C: Global utilization of low-dose corticosteroids in severe sepsis and septic shock: a report from the PROGRESS registry. Crit Care. 2010, 14: R102.
88. Dellinger RP, Levy MM, Rhodes A et al. Surviving Sepsis Campaign guidelines for the management of severe sepsis and septic shock. Crit Care Journal. 2013; vol 41 n.2.
89. Marik Glucocorticoids in sepsis: dissecting facts from fiction. Critical Care. 2011, 15: 158.
90. Delaney AP, Dan A, McCaffrey J, Finfer S. The role of albumin as a resuscitation fluid for patients with sepsis: a systematic review and meta-analysis. Crit Care Med. 2011 Feb; 39 (2): 386-91.
91. Delaney AP, Dan A, McCaffrey J, Finfer S, Ann Emerg Med. 2012 May;59(5):432-3.
92. Tollefson BJ, Jones AE. Does resuscitation with albumin-containing solutions improve mortality in sepsis?. Crit Care Med. 2011 Feb; 39 (2): 418-9.
93. Han J, Martin GS. Does albumin fluid resuscitation in sepsis save lives? Crit Care Med. 2011 Feb; 39 (2): 418-9.
94. Available at: http://clinicaltrials.gov/ct2/show/NCT00327704. Accessed August 18, 2011.
95. College of American Pia Thologists. Practice parameter for the use of fresh-frozen plasma, cryoprecipitate and platelets. JAMA 1994; 271: 777-81.
96. Haemato BrJ. Guidelines for the use of platelet transfusions. 2003; 122: 1023.
97. Van den Berghe G, Wilmer A, Hermans G et al. Intensive Insulin Therapy in the Medical ICU. Ph.D.N Engl J Med. 2006; 354: 449-461.
98. The NICE-SUGAR Study Investigators, Intensive versus Conventional Glucose Control in Critically III Patients, N Engl J Med. 2009; 360: 1283-1297.
99. Dellinger RP, Levy MM, Rhodes A et al. Surviving Sepsis Campaign guidelines for the management of severe sepsis and septic shock. Crit Care Journal. 2013; vol 41 n.2.
100.Martí-Carvajal AJ, Solà I, Gluud C, Lathyris D, Cardona AF. Human recombinant protein C for severe sepsis and septic shock in adult and paediatric patients. Cochrane Database Syst Rev. 2012
101.Eliezer S, Poli de Figueiredo LF, Colombari F. Prowess-shock trial: a protocol overview and perspective shock. 2010; 34, Supplement 1: 48-53.
102.Gaieski et al. Impact of time to antibiotics on survival in patients with severe sepsis or septic shock in whom early goal-directed therapy was initiated in the emergency department. Critical Care Medicine. 2010; 38: 1045-1053.
103.Kumar, Anand. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Critical Care Medicine. 2006; 34: 1589-1596.
104.McCabe WR, Jackson GG. Gram negative bacteremia. Arch Intern Med. 1962; 110: 92-100.
105.Kreger BE, Craven DE, McCabe WR. Gram negative bacteremia. IV. Re-evaluation of clinical features and treatment in 612 patients. Am J Med 1980; 68: 344-355.
106.Leibovici L, Shraga, Drucker M, et al. The benefit of appropriate empirical antibiotic treatment in patients with bloodstream infection. Intern Med 1998; 244: 379-386.
107.Ibrahim EH, Sherman G, Ward S, et al. The influence of inadequate antimicrobial! Treatment of bloodstream infections on patient outcomes in the ICU setting. Chest. 2000; 118: 146-155.
108.Kumar A, et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med. 2006; 34: 1589.
109.Kumar A, et al. Initiation of inappropriate antimicrobial therapy results in a fivefold reduction of survival in human septic shock. Chest. 2009; 136: 1237.
110.Ali MZ, Goetz MB. A meta-analysis of the relative efficacy and toxicity of singe daily dosing versus multiple daily dosing of aminoglycosides. Clin Infect Dis. 1997; 24: 796-809.
111.Amsden GW,, Bailow CH, Bertino JS. Pharmacokinetics and Pharmacodynamics of Anti-infective Agents. Fifth Edition. Mandeli CL, BennettJE, Dolin R (Eds). Philadelphia,Churchill Livingstone, 2000; 253-261.
112.Hyatt JM, McKinnon PS, Zimmer CS, et al. The importance of pharmacokineticlphar macodynamic surrogate markers to out comes. Focus on antibacterial agents. Clin Pharmacokinet. 1995; 28: 143-160.
113.Dellinger RP, et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008. Crit Care Med. 2008 Jan; 36 (1): 296-327.
114.Kumar et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Critical Care Medicine. 2006; 34: 1589-1596.
115.Dellinger RP, Levy MM, Rhodes A et al. Surviving Sepsis Campaign guidelines for the management of severe sepsis and septic shock 2012. Crit Care Journal. 2013; 41: 2.
116.Dellinger RP, Levy MM, Rhodes A, et al. Surviving Sepsis Campaign guidelines for the management of severe sepsis and septic shock: 2012. Crit Care Journal. 2013; 41: 2.
117.Pappas PG, Kauffman CA, Andes D, et al. Infectious Diseases Society of America: Clinical practice guidelines for the management of candidiasis: 2009 update by Infectious Diseases Society of America. Clin Infect Dis. 2009; 48: 503-535.
118.Safdar N, et al. Does combination antimicrobial therapy reduce mortality in Gram- bacteriaemia? A meta-analisys. Lancet Infect Dis. 2004; 519.
119.Chamot E, Boffi El Amaru E, Rohner P, et al. Effectiveness of combination antimicrobial therapy for Pseudomonas aeuriginosa septicemia. Antimicrob Angents Chemother 2003; 47: 2756-2764.
120.Coburn B, Morris AM, Tomlinson G, Detsky AS. Does This Adult Patient With Suspected Bacteremia Require Blood Cultures?. JAMA. 2012; 308: 502-11.