- Lucia Tassinari, Gianfranco de Rose
- Area giovani
Una strana aritmia
- 2 - Maggio 2013
- ISSN 2532-1285
Abstract
Torsade de pointes is an uncommon form of polymorphic ventricular tachycardia (VT) characterized by a gradual change in the amplitude and twisting of the QRS complexes around the isoelectric line. Frequently may degenerate into ventricular fibrillation. Torsade is associated with a prolonged QT interval, which may be congenital or acquired. A very large number of drugs may be responsible of acquired long-QT. This is a case of a torsade de pointes due to concomitant use of methadone and antiretroviral drugs.
Introduction
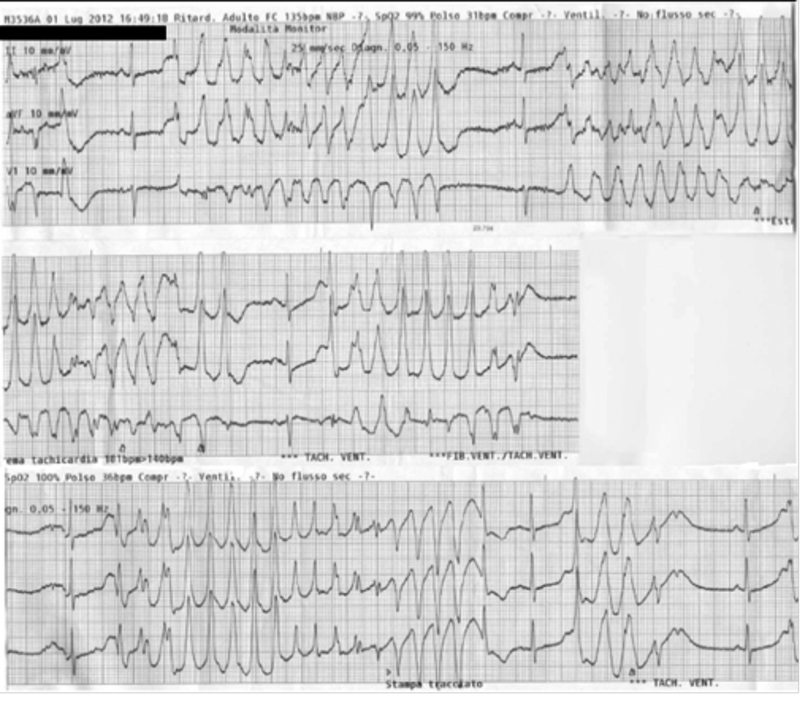
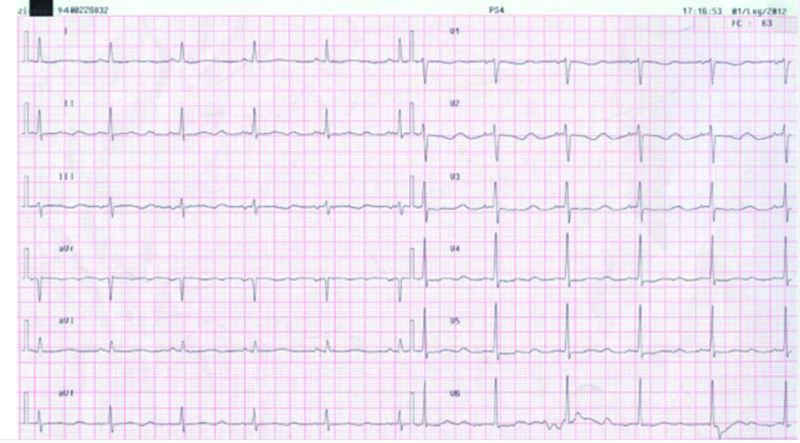
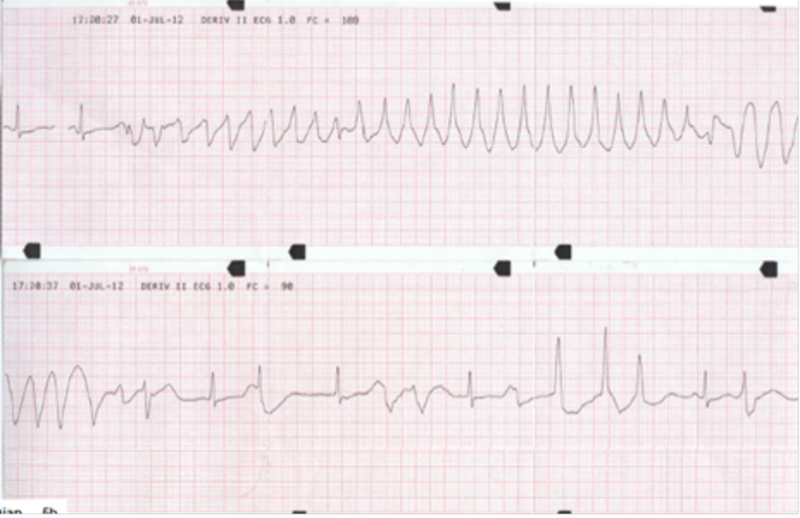
L’ambulanza medicalizzata del 118 arriva in Pronto Soccorso con un uomo di 48 anni che lamenta malessere generale ed episodi presincopali da diverse ore. Il paziente è affetto da epatopatia cirrogena mista HCV correlata, storia di abuso di sostanze esotossiche, malattia HIV stadio C3; è seguito dal SERT e sottoposto a trattamento con Metadone 60 mg/die, antiretrovirali (reyatzad 200X 2 e truvada) e propanolo. All’arrivo dei soccorsi si presenta vigile, con cute asciutta senza segni di vasocostrizione, PA 100//60 mmHg, FC 67 bpm, saturazione 98%, lievemente dispnoico. Il medico del 118, in seguito al riscontro di episodi di tachicardia ventricolare non sostenuta associati a breve perdita di coscienza, somministra amiodarone 225 mg ev (1+1/2 fl) (figura 1). All’arrivo in PS il paziente si presenta vigile, orientato, senza segni di vasocostrizione e con obiettività cardiorespiratoria e neurologica nella norma, PA 100/65 mmHg, FC 65 bpm, saturazione 98 con FR 28. Viene eseguita un’emogasanalisi che presenta Ph 7,65; pCO2 17,28 mmHg; pO2 86,5 mmHg; bicarbonato 19,3 mmol/L; Na 135,2 mmol/L; K 3,47; Ca 4,3 mg/dl; Cl 104 mmol/L; Lattati 3,81 mmol/L, glicemia190 mg/dl. Nella fase di Pronto Soccorso il paziente continua a presentare ogni 2-3 min episodi di tachicardia non sostenuta. L’ECG mostra ritmo sinusale con FC di 65 bpm, anomalie aspecifiche della ripolarizzazione con QT prolungato (figura 2). Il medico di PS alla luce dei dati acquisiti decide di somministrare una fiala di Magnesio Solfato in 250 cc di fis. in 2-5 min. Terminata l’infusione di Magnesio Solfato il paziente continua a presentare episodi tachiaritmici circa ogni 2 min. Gli episodi vengono avvertiti dal paziente che sin dai primi battiti urla: “Arrivaaa!” (figura 3). Il medico
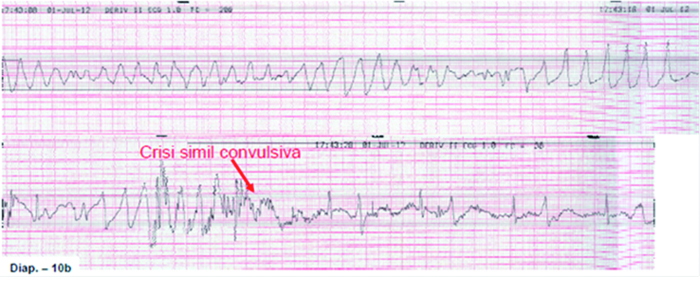
di PS sulla base dei valori dell’emogasanalisi decide di somministrare una fiala di Calcio Cloruro in 100 cc di fis. in 2 min. Durante un episodio tachiaritmico della durata superiore a 6 sec il paziente presenta un episodio di trisma ed un irrigidimento similconvulsivo, Sindrome di Morgagni-Adams-Stokes (figura 4). Il medico di PS decide di elettrostimolare il paziente applicando lo SCE (placche posizionate in antero-posteriore; frequenza di stimolazione 100 bat/min; stimolazione a demand; aumento progressivo dell’energia 10-20-40 fino ad 80 mAmp). Scarso l’effetto dell’elettrostimolatore: il paziente tollera male lo SCE nonostante l’analgosedazione, e pertanto si sospende la stimolazione elettrica. Nel frattempo arrivano gli esami: RBC 3.560.000, WBC 4.320 Hb 13,2 g/ dl, MCV 108,7, PLT 116000, Creatinina 0,68 mg/dl, glicemia 168 mg/dl, sodio 132 mEq/L, potassio 3,2mEq/L, calcio 8,5 mg/dL, PT-INR 1,77.
Il paziente viene ricoverato in UTIC, dove, alla luce dei dati acquisiti, si decide di infondere Isoprenalina alla velocità iniziale di 6mcg/ora (5 FL in 100 cc 36ML/H), regolando l’infusione sino ad ottenere un aumento della FC da 67 batt/min a 75-80 batt/min; questa viene sospesa dopo alcune ore. Durante il ricovero si provvede alla correzione dello squilibrio elettrolitico mediante infusione di magnesio e potassio, con cessazione degli episodi aritmici.
Figura 1. Tracce monitor 118.
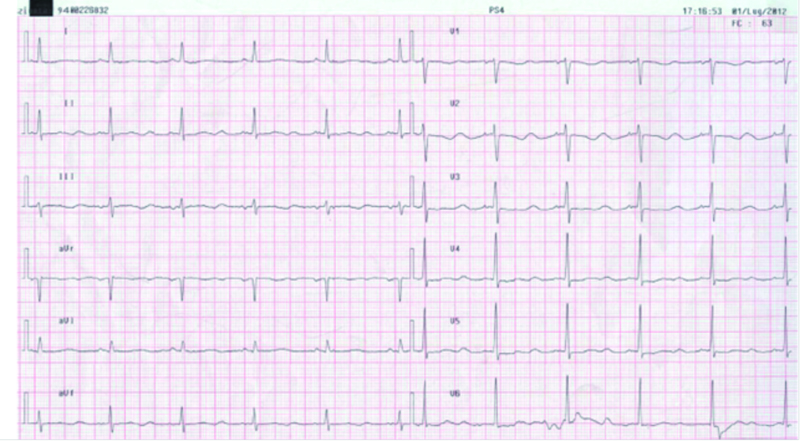
Figura 2.ECG all’arrivo in PS.
Figura 3.Tracce monitor in PS.
Figura 4. Tracce monitor in PS.
Tabella 1. Classi di farmaci associati con la torsione di punta.
• Classe IA: chinidina, disopiramide, procainamide chinidina, disopiramide.
• Classe III: sotalolo, amiodarone (rare), ibutilide, dofetilide, almokalant.
Altre classi di farmaci associate con la torsione di punta includono:
• Antibiotici: eritromicina, claritromicina, azitromicina, levofloxacina, moxifloxacina, gatifloxacina, trimetoprim-
sulfametossazolo , clindamicina, pentamidina, clorochina.
• Antifungini: ketoconazolo, itraconazolo.
• Antivirali: amantadina, farmaci antiretrovirali.
• Antipsicotici: aloperidolo, fenotiazine, tioridazina, trifluoperazina, sertindolo , zimeldina, ziprasidone.
• Antidepressivi triciclici e tetraciclici.
• Antistaminici (antagonisti dei recettori istaminici H1): terfenadina, astemizolo, difenidramina, idroxizina.
• Antagonisti colinergici: cisapride, organofosfati (pesticidi).
• Diuretici: indapamide, idroclorotiazide, furosemide.
• Antipertensivi: bepridil, lidoflazina, prenilamina, ketanserina.
• Litio.
• Anticonvulsivanti: fenitoina, carbamazepina (possibile).
• Ipoglicemizzanti orali.
• Citrato (massicce trasfusioni di sangue).
• Cocaina, metadone.
• Vasopressina (possibile).
• Fluoxetina (possibile).
Alcuni farmaci (per esempio l’amiodarone) prolungano di routine il QT, ma sono meno comunemente associati
a conseguenze cliniche dovute al QT lungo.
Discussion
La torsione di punta è una forma insolita di tachicardia ventricolare caratterizzata da oscillazioni ad elevata frequenza dei complessi QRS rispetto alla linea elettrocardiografica di base, che può esitare in un’aritmia polimorfa. Di solito ha inizio con un battito ventricolare prematuro nell’ambito di una ripolarizzazione ventricolare anomala caratterizzata dal prolungamento dell’intervallo Q-T. Può essere secondaria a forme di QT lungo congenito (Sindromi di Jerwell-Lange-Nielsene Romano-Ward), a forme acquisite su base disionica (ipokaliemia, ipomagnesiemia, ecc.), a farmaci ( vedi lista ), ma anche a lesioni del sistema nervoso centrale, miocardite, ischemia del miocardio e marcata bradicardia. La rimozione delle cause e la correzione della disionia sono alla base del trattamento (Solfato di Magnesio: bolo e.v. 1-2 g in 5-10 min seguito da infusione 1-2 g/h per 4-6 ore + Cloruro di Potassio: 10 m Eq/h fino a correzione della disionia). Altra strategia terapeutica è l’incremento della frequenza cardiaca (Isoproterenolo: 0,01-0,02 microg/Kg/min per infusione continua fino a stabilizzazione, oppure Atropina e.v.: bolo e.v. 0,5 mg, ripetibile ogni 10 min fino ad un max di 3 mg). Si può anche considerare l’elettrostimolazione temporanea (100-120/min: atriale o ventricolare). Nelle forme congenite e nell’intossicazione da antidepressivi triciclici si possono adoperare betabloccanti (esmololo, metoperololo). Nel caso riportato la causa del QT prolungato, che ha generato la torsione di punta, è da ritenersi in prima ipotesi secondaria all’utilizzo di farmaci. La lista dei farmaci in grado di allungare il QT è veramente sterminata: tra questi vanno annoverati anche gli antiretrovirali ed il metadone, che il paziente assumeva in terapia domiciliare. Una puntualizzazione a parte merita l’amiodarone usato nella fase territoriale: questo è sicuramente controindicato per la sua azione bradicardizzante e, talora, di allungamento del QT. Fortunatamente gli effetti pro-aritmici sono stati limitati dall’azione dell’amiodarone, farmaco poliedrico dotato anche di effetti stabilizzanti sull’eccitabilità di membrana. A nostro giudizio la lieve ipokaliemia ha contribuito solo in parte alla genesi dell’aritmia, che sembrerebbe piuttosto correlata al prolungamento del QT
dovuto alla terapia con antiretrovirali e metadone.
Conclusions
In sesta giornata il paziente viene dimesso con diagnosi di aritmie ventricolari (torsione di punta) in paziente con QT lungo iatrogeno e concomitante ipokaliemia.
Bibliografia
Tzivoni D, Banai S, Schuger C, Benhorin J, Keren A, Gottlieb S, et al. Treatment of torsade de pointes with magnesium sulfate. Circulation. 1988 Feb; 77(2): 392-7.
Gupta A, Lawrence AT, Krishnan K, Kavinsky CJ, Trohman RG. Current concepts in the mechanisms and management of drug-induced QT prolongation and torsade de pointes. Am Heart J. 2007 Jun; 153(6): 891-9.
Wegener HT, Ehrlich JR, Hohnloser SH. Amiodarone – associated macroscopic T – wave alternans and torsade de pointes unmasking the inherited long QT syndrome. Europace, 2008. 2 voll. 10, n. 1, 112–113.
Prosser JM, Mills A, Rhim ES, Perrone J. Torsade de pointes caused by polypharmacy and substance abuse in a patient with human immunodeficiency virus. Int J Emerg Med. 2008; 1: 217-220.
Krantz MJ, Lewkowiez L, Hays H, et al. Torsades de pointes associated with very-high-dose methadone. Ann Intern Med. 2002; 137(6): 501-4.
Fanoe S, Hvidt C, Ege P, Jensen GB. Syncope and QT prolongation among patients treated with methadone for heroin dependence in the city of Copenhagen. Heart. 2007; 93: 1051-1055.
Commento
a cura di Federica Stella
Medico in Formazione Specialistica, Scuola di Specializzazione in Medicina di Emergenza-Urgenza, Università degli Studi di Padova
Il caso clinico dei colleghi del PS di Cesena ci permette alcune riflessioni sulla gestione del paziente che si presenta con torsione di punta. Trattandosi di un’aritmia peculiare che prevede un trattamento diverso dalle altre aritmie ventricolari, questa deve essere identificata prontamente per poter essere correttamente trattata.
L’esatta epidemiologia della torsione di punta non è nota, in quanto esordisce spesso con un episodio sincopale o con sincopi ricorrenti in ambito extraospedaliero. Ciò serve a sottolineare, ancora una volta, come l’esecuzione precoce di un ECG ed il posizionamento di un monitoraggio ECGrafico in continuo permettano di evidenziare cause aritmiche alla base di episodi sincopali.
La torsione di punta è l’aritmia di tipica insorgenza in corso di sindrome del QT lungo, e si manifesta per una complessa interazione tra fattori strutturali, metabolici, genetici e farmacologici. Cause scatenanti che generano instabilità elettrica, come disionie, ischemia miocardica ed assunzione di farmaci che inducono allungamento del QT sono ben riconosciute e studiate dalla letteratura. Il rapido riconoscimento e trattamento di tali cause riveste un ruolo primario per il controllo e la risoluzione dell’aritmia. Come nel caso presentato, le disionie ed i farmaci possono coesistere nello scatenarne l’insorgenza e nel sostenerne gli episodi subentranti. L’esecuzione di un EGA all’arrivo del paziente permette una rapida valutazione ed eventuale correzione degli squilibri idroelettrolitici.
La raccolta di un’accurata anamnesi farmacologica è quindi di cruciale importanza per il riconoscimento e la ricerca di eventuali cause iatrogene dell’allungamento del tratto QT. La pronta identificazione e sospensione del farmaco potenzialmente responsabile di allungamento del QT permettono il ripristino della stabilità elettrica e quindi l’interruzione della aritmia, con le tempistiche correlate all’emivita plasmatica del principio attivo.
Nel caso vi sia il sospetto di una sindrome congenita del QT lungo (long QT syndrome – LQTS), ad esempio in pazienti con storia familiare di morte improvvisa, o in pazienti con allungamento del tratto QT senza cause evidenziabili, può essere ruolo del medico di PS suggerire una valutazione aritmologica, al fine di sottoporla ad un eventuale studio genetico. Nel caso di sindromi congenite, infatti, deve essere importata una terapia con antiaritmici in cronico e deve essere valutata la possibilità dell’impianto di un ICD. Cogliamo infine l’occasione per ricordare che, se l’allungamento del QT riveste un ruolo noto e riconosciuto dalla letteratura internazionale nella genesi della torsione di punta, si stanno studiando ed identificando sia ulteriori sindromi caratterizzate da alterazioni del tratto QT, sia i geni responsabili di tali alterazioni, che sottendono ad altrettanta instabilità elettrica. In particolare l’accorciamento del tratto QT, che configura la sindrome del QT corto (short QT syndrome – SQTS), è a sua volta correlata con l’insorgenza di aritmie ventricolari, non di tipo torsione di punta, ma bensì fibrillazione ventricolare.