- Elisa Pontoni
- Original Article
Proposta di un protocollo regionale sulla sepsi: cosa fare nella prima ora?
- 3/2017-Ottobre Supplemento
- ISSN 2532-1285
- https://doi.org/10.23832/ITJEM.2017.036
E. Pontoni
“La sepsi è una delle patologie più comuni, meno riconosciute proprie sia del mondo industrializzato che dei paesi in via di sviluppo. Complessivamente, colpisce dai 20 ai 30 milioni di pazienti l’anno, con circa 6 milioni di sepsi neonatale/infantile annui e più di 100.000 casi di sepsi materna. Nel mondo, una persona muore di sepsi ogni pochi secondi”
(World Sepsis Declaration)
La difficoltà nella gestione della sepsi, la cui incidenza e mortalità sono già state esplicitate nella dichiarazione sopra riportata, risiede nell’incapacità talora di sospettarla e riconoscerla, nel non considerarla un’emergenza medica, nel sottostimarne la mortalità e nell’incapacità di gestirla in maniera semplice e sistematica.
Come sottolineato nel documento “Surviving Sepsis Campaign responds to Sepsis-3, March 2016”, il focus primario rimane il rapido riconoscimento e la tempestiva gestione del paziente settico: ciò si può attuare mediante l’impiego sistematico di una procedura di valutazione, di rivalutazione programmata e la definizione delle soglie di allerta, con conseguente attivazione di azioni di risposta in base ad algoritmi decisionali.
L’identificazione dei pazienti settici, il sospetto clinico di sepsi e la successiva stratificazione prognostica, sono l’aspetto più complesso della gestione nel Pronto Soccorso. E’ necessario che ai pazienti con sospetta sepsi venga assegnato un codice di priorità elevato per evitare che venga perso del tempo prezioso durante l’attesa prima della valutazione medica.
Il National Early Warning Score (NEWS) come altre scale a punteggio possono essere utilizzate per la valutazione seriata del paziente: il loro principio di base è quello di raccogliere parametri fisiologici di usuale e facile reperimento, quali frequenza cardiaca, pressione arteriosa, temperatura corporea, frequenza respiratoria, riunendoli in una scala a punteggio che consenta una veloce e condivisa valutazione di medici e infermieri dello stato clinico dei pazienti.
Nella Consensus Conference 2016, è stato definito un nuovo score clinico, il qSOFA (quick SOFA), che permette una semplice e precoce identificazione dei pazienti settici a maggiore rischio di evoluzione negativa. Risulta “positivo” se almeno due dei seguenti criteri sono soddisfatti:
- Frequenza respiratoria ≥ 22 atti/min
- Alterazione dello stato di coscienza
- Pressione arteriosa sistolica ≤ 100 mmHg.
In relazione a possibili algoritmi decisionali, i colleghi dell’ACEP (American College of Emergency Physicians), propongono un approccio assai pragmatico al paziente settico, riassunto nell’acronimo DART: detect-act-reasess-titrate.
DETECT:
– IDENTIFY SEPSIS EARLY
– MEASURE LACTATE
- IDENTIFY SEPSIS EARLY: sospetta sepsi/shock settico in tutti quei casi di presentazione classica con febbre, leucocitosi e ipotensione, ma anche nei casi di alterazione dello stato mentale, tachipnea con normale indagine radiologica toracica e normale ossigenazione, o in tutti quei casi in cui il giudizio clinico suggerisca qualcosa di anormale in un paziente affetto da un’infezione apparentemente banale.
- MEASURE LACTATE: viene considerato quale cut off una lattatemia >2, >4 è indice di ipoperfusione occulta e richiede manovre rianimatorie; se la lattatemia iniziale è elevata, l’obiettivo è il raggiungimento di una clearance >10% entro 2 ore.
Un modello alternativo ed ugualmente efficace per il riconoscimento del paziente settico è quello proposto dai colleghi anglosassoni (UK SEPSIS TRUST), riassunto nella mappa decisionale rappresentata nella tabella 1.
Tabella 1. Algoritmo decisionale della UK SEPSIS TRUST
|
1. Il paziente ha un NEWS score di 3 o superiore, o appare critico? |
|
2. Se sì, può questa condizione essere legata ad un’infezione? |
|
a. sì, infezione ad origine non nota
|
|
b. possibile polmonite
|
|
c. possibile affezione vie urinarie
|
|
d. dolore o distensione addominale
|
|
e. cellulite/artrite settica/ ferita infetta
|
|
f. infezione legata a devices
|
|
g. meningite
|
|
h. altro
|
|
3. E’ presente almeno una red flag: |
|
a. risposta solo alla voce o al dolore/non responsivo
|
|
b. SBP< 90 mmHG o decremento >40 mmHG rispetto a valori normali
|
|
c. FC>130 bpm
|
|
d. FR> 25/minuto
|
|
e. necessità supporto ossigeno per sat.>92%
|
|
f. marezzatura cutanea, cianosi
|
|
g. anurico nelle 18 ore precedenti
|
|
h. diuresi inferiore a 0.5 ml/kg/h
|
|
i. lattati> 2 mmol/l
|
|
j. recente chemioterapia
|
|
4. E’ presente almeno una “amber flag”: |
|
a. familiari preoccupati per lo stato mentale del paziente
|
|
b. deterioramento acuto in un’abilità funzionale
|
|
c. immunosoppressione
|
|
d. trauma/chirurgia/processo invasivo nelle 6 settimane precedenti
|
|
e. FR 21-24/min o difficoltà respiratoria
|
|
f. SBP 91-100 mmHG
|
|
g. FC 91-130 bpm o nuova aritmia
|
|
h. anuria nelle 12-18 ore precedenti
|
|
i. t<36 °C
|
| j. segni clinici di infezione cute, device o ferita |
Secondo il protocollo della UK SEPSIS TRUST, un paziente che appaia critico con almeno una red flag dovrebbe essere subito sottoposto ai SEPSIS SIX (VD INFRA); un paziente potenzialmente settico con almeno un amber flag dovrebbe essere sottoposto a determinazione laboratoristica e rivalutato da medico esperto in sepsi entro 1 ora.
ACT:
– GIVE A CRYSTALLOID BOLUS
– START ANTIBIOTICS EARLY
- GIVE A CRYSTALLOID BOLUS: l’ultima versione delle Linee Guida della Surviving Sepsis Campaign mantiene l’indicazione al bolo iniziale di fluidi (30 ml/kg) ma sottolinea anche l’importanza del monitoraggio nelle fase successiva di gestione emodinamica. Quando si parla di espansione volemica è infatti necessario tenere in considerazione i concetti di fluido responsività e fluido tolleranza, particolarmente delicati nel paziente settico e che sono stati ampiamente trattati nei capitoli precedenti.
- START ANTIBIOTICS EARLY: la tempestiva somministrazione di un’appropriata terapia antibiotica entro 60 minuti dall’identificazione della sepsi e dopo il prelievo di appropriate colture è essenziale per un efficace trattamento: ogni ora di ritardo si associa ad un significativo incremento della mortalità (KUMAR, 2006). Risulta fondamentale la scelta dell’iniziale terapia antibiotica empirica, basata su criteri clinici, epidemiologici, ed adeguata nel dosaggio, da somministrarsi con tempestività a tutti i pazienti con sepsi-shock settico con l’obiettivo di raggiungere la massima efficacia possibile. Nelle fasi successive la terapia dovrà essere rivalutata giornalmente con l’obiettivo di procedere ad una corretta de-escalation therapy nell’ottica di una attenta stewardship antibiotica, in accordo, laddove presenti, con le LG regionali.
La somministrazione dell’antibioticoterapia deve essere preceduta dall’esecuzione degli esami microbiologici, essenziali per la corretta diagnosi della sepsi: le colture appropriate (sangue, urine, espettorato, feci, materiale da raccolte, drenaggi, dispositivi, antigeni urinari precoci) devono essere raccolte prima dell’inizio della terapia antibiotica.
Le emocolture rappresentano il gold standard nella diagnosi microbiologica di sepsi, si eseguono prelevando dei campioni ematici mediante tecnica sterile, i campioni vengono poi seminati su appositi terreni di coltura. L’isolamento di batteri o funghi dal sangue conferma il sospetto diagnostico, identifica l’eziologia microbica e fornisce indicazioni utili per la terapia antibiotica mirata.
Nel sospetto di una sepsi, il prelievo deve essere effettuato in qualunque momento dell’episodio febbrile, meglio se durante la fase di brivido.
Le modalità di raccolta, conservazione, invio e lavorazione sono essenziali per garantire risultati attendibili e utili: per assicurare una maggiore sensibilità, è bene effettuare non meno di 2 set completi di prelievi (tenendo in considerazione che ciascun prelievo deve essere composto da un flacone per aerobi ed uno per anaerobi); tali indagini devono essere eseguite in rapida successione, da vena periferica oppure da devices in situ (se presenti per un tempo >48 h) nel sospetto di un’infezione catetere correlata. La loro esecuzione non deve comportare un ritardo eccessivo (>45 min) nell’inizio della terapia antibiotica.
I segni clinici della sepsi/shock settico devono essere inoltre integrati da esami di laboratorio utili a definire la gravità della patologia e ad indirizzare il trattamento.
E’ necessaria la definizione di una procedura per la richiesta di tali esami volti all’inquadramento clinico del paziente, che devono poter essere effettuati in urgenza 7 giorni su 7.
Si raccomanda la predisposizione di un’interfaccia nella cartella informatizzata per la richiesta di esami predefiniti (‘pannello sepsi’), prelevati dagli infermieri in autonomia (vedi tabella 1)
Tabella 1. Esami da acquisire nel paziente con sospetta Sepsi
|
Pannello sepsi |
|
emogasanalisi arteriosa
|
|
emocromo
|
|
coagulazione (PT, PTT)
|
|
Creatinina, urea
|
|
glicemia
|
|
Na, K, Cl
|
|
bilirubina totale e diretta
|
|
AST, ALT
|
| PCR |
|
Procalcitonina
|
La procalcitonina è stata inclusa non tanto per la fase diagnostica in PS ma perché ritenuta guida fondamentale nella stewardship antibiotica alla luce delle evidenze della letteratura internazionale. Se non acquisita in PS deve essere ottenuta entro le 12 ore.
REASSESS:
-REMEASURE LACTATE
-REASSESS AFTER BOLUSES
- REMEASURE LACTATE: la riduzione della concentrazione di acido lattico sembrerebbe essere un valido indicatore di prognosi migliore dopo l’avvio del trattamento rispetto a concentrazioni stabili o addirittura in aumento; a fronte di un miglioramento dei parametri vitali e dei segni di perfusione periferica, il riscontro di concentrazioni persistentemente elevate di acido lattico dovrebbe spingere ad una rivalutazione del paziente e della strategia terapeutica (Henning, 2016).
- REASSESS AFTER BOLUSES: ricerca i segni di un’adeguata espansione volemica o sue possibili complicanze. La Consensus dell’European Society of Intensive Care Medicine (2014) sul monitoraggio emodinamico del paziente con shock non fornisce specifiche indicazioni ma afferma chiaramente che la fluidoterapia deve essere guidata dalla valutazione di più parametri emodinamici, che è preferibile affidarsi alle variabili dinamiche piuttosto che alle statiche (ad es.PVC) e che la somministrazione dei fluidi deve avvenire secondo la tecnica del fluid challenge (infondere in 30 minuti un carico di fluidi di 250-500 cc e valutare la risposta emodinamica del paziente) a meno che non vi siano condizioni di chiaro shock ipovolemico (ad es. rottura di aneurisma dell’aorta addominale).
Analogamente, i Colleghi dell’ACEP suggeriscono almeno 2 delle seguenti metodiche: Passive Leg Raising (manovra sovrapponibile ad “autotrasfusione” realizzabile sollevando gli arti inferiori in paziente in posizione semiseduta, valutando, se disponibile una linea arteriosa, la pulse pressione variation >13% o variazione della frequenza cardiaca). Una metodica non invasiva, ripetibile, maneggevole e altrettanto sensibile ed accurata per la stima del microcircolo e della congestione extravascolare polmonare è rappresentata dalla Lung Ultra Sound (LUS): l’ecografia toracica è l’ecografia degli artefatti derivanti dalla variazione del rapporto aria/fluido all’interno del polmone. In alternativa, suggeriscono la determinazione delle variazioni dello stroke volume, l’ormai desueto monitoraggio della pressione venosa centrale e il già citato monitoraggio seriato della lattacidemia.
TITRATE:
-MONITOR PATIENT RESPONSE
-ADDRESS ONGOING HYPOTENSION
- MONITOR PATIENT RESPONSE: fondamentale monitoraggio multiparametrico quale guida per espansione volemica/utilizzo precoce dei vasopressori, guidati da fluidoresponsività/fluidotolleranza del paziente.
- ADDRESS ONGOING HYPOTENSION: in paziente con ipotensione persistente non responsiva ad espansione volemica, è indicato l’utilizzo di noradrenalina, con l’obiettivo di raggIungere MAP>65 mmHG.
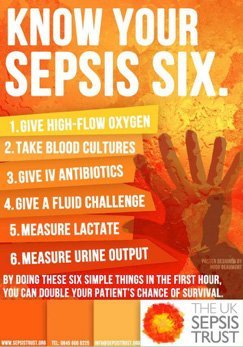
I colleghi anglosassoni (Ron Daniels, UK SEPSIS TRUST) hanno proposto un modello operativo (‘sepsis six’) delle azioni da compiere entro la prima ora nel paziente settico, basato su tre azioni diagnostiche (esecuzione emocolture, misurazione lattacidemia, monitoraggio diuresi) e tre azioni terapeutiche (somministrazione O2 se necessario, espansione volemica, antibioticoterapia).
Questo modello operativo ha dimostrato di abbattere del 50% la mortalità per sepsi.
A completamento delle azioni suddette, si sottolineano i seguenti punti:
- L’esecuzione di indagini diagnostiche (radiografia, TAC, ecografia) mirate è utile a identificare la sorgente di infezione, alla sua eradicazione, all’attuazione di un trattamento mirato, ed accresce le possibilità di un trattamento efficace.
- La precoce identificazione di un focolaio di infezione potenzialmente eradicabile, ed il successivo trattamento di eradicazione (asportazione, drenaggio, rimozione ecc.), subito dopo l’iniziale stabilizzazione, sono essenziali per il controllo del quadro clinico. In questo modo è anche possibile l’identificazione precoce dei microrganismi responsabili.
- In assenza di evidenze definitive, valori di emoglobina compresi tra 7 e 9 g/dl non comportano un incremento di mortalità, e, in conformità con le conclusioni del Transfusion Requirements in Critical Care Trial, si considera valida la soglia trasfusionale di 7 g/dl (in assenza di situazione particolari, quali l’ischemia miocardica, l’ipossiemia refrattaria, ecc.) dopo che l’ipoperfusione tissutale è stata risolta.
- Sono raccomandate le manovre a minor invasività e a minor impatto sistemico, rimandando il trattamento definitivo alla fase di raggiunta stabilizzazione delle funzioni vitali.
Bibliografia
- worldsepsisday.org
- Surviving sepsis.org.guidelines
- rcplondon.ac.uk>outputs
- org
- acep.org.dart
- Singer M et.al, The third international consensus definition for sepsis and septic shock (sepsis-3). JAMA 2016 Feb.23,315(8):801-10.
- Cecconi M.et L, Consensus on circulatory shock and hemodynamic monitoring. Task force of the European Society of Intensive Care Medicine. Intensive Care Medicine, 2014 dec 40(12):1795-815.
- Herbert MD et.al, A Multicenter randomized controlled critical trial of transfusion in critical care. NEJM, 1999:340:409-417.
- Daniels R, Nutbeam T, McNamara G, Galvin C. The sepsis six and the severe sepsis resuscitation bundle: a prospective observational cohort study. Emerg Med J. 2011 Jun;28(6):507-12. doi: 10.1136/emj.2010.095067. Epub 2010 Oct 29.
- Prko A. et al, Procalcitonin-guided therapy in intensive care unit patients with severe sepsis and septic shock-a systematic review and meta-analysis. Critical Care 2013;17:R291.