- Andrea Sonaglioni
- Articoli originali
Il ruolo dell’ecocardioscopia nella diagnosi precoce di masse cardiache e pseudomasse in Pronto Soccorso
- X - Novembre 2014
- ISSN 2532-1285
Andrea Sonaglioni, Graziana Trotta, Giandomenico Gullà, Maria Munteanu, Marco Bordonali, Michele Lombardo
Abstract
The principal role for focused cardiac ultrasound (FCU) is the time-sensitive assessment of the symptomatic patient in the Emergency Department. This evaluation primarily includes the assessment for the presence of pericardial effusion and the evaluation of relative chamber size, global cardiac function, and patient volume status. Intravascular volume status may be assessed by left ventricular size, ventricular function, and inferior vena cava size and respiratory change. In addition, FCU is used to guide emergent invasive procedures, such as pericardiocentesis, or evaluate the position of transvenous pacemaker placement. Other pathologic diagnoses (intracardiac masses, left ventricular thrombus, valvular dysfunction, regional wall motion abnormalities, endocarditis, aortic dissection) may be suspected on FCU, but additional evaluation, including referral for comprehensive echocardiography or cardiology consultation, is recommended. We present a review of intracardiac masses early detected by FCU in our Emergency Department.
Focused Cardiac Ultrasound (FCU) è la terminologia più corretta per definire il ruolo dell’ecocardioscopia in Pronto Soccorso [1].
Si tratta di un esame strumentale focalizzato sul sistema cardiovascolare eseguito con l’impiego degli ultrasuoni che, in aggiunta all’esame obiettivo, identifica o esclude specifici rilievi patologici, usando un protocollo di acquisizione delle immagini ben definito e pre-stabilito.
È una metodica rapida, da eseguirsi in pochi minuti (3-5 minuti), spesso in contemporanea ad altre procedure o pratiche salva-vita, non invasiva, mirata, che fornisce preziose informazioni sulla criticità del paziente ed attualmente ha un ruolo emergente in Pronto Soccorso.
Il suo principale ruolo è il rapido inquadramento diagnostico del paziente sintomatico [2-6]. Questa valutazione comprende la ricerca di versamento pericardico, lo studio delle dimensioni delle camere cardiache e della funzione cardiaca globale, e infine la definizione dello stato di riempimento volemico del paziente. Quest’ultimo può essere dedotto dalle dimensioni del ventricolo sinistro, dalle caratteristiche della funzione ventricolare, e dalla visualizzazione della VCI e della sua reattività respiratoria.
Inoltre, tale tipo di ecografia è impiegato come guida all’esecuzione di procedure invasive in emergenza, come la pericardiocentesi, o per valutare la corretta posizione del catetere elettrodo posizionato per via transvenosa femorale [4,6].
Quando possibile, tutte e tre le finestre ecocardiografiche (parasternale, apicale quattro camere e sottocostale) devono essere utilizzate per ottenere una completa visualizzazione del cuore. Oltre a fornire una risposta a domande di base, l’ecocardioscopia può fornire numerose altre informazioni nell’ambito
del Pronto Soccorso e dell’urgenza. In particolare, nel corso di una valutazione FCU in Pronto Soccorso, non è infrequente il riscontro, spesso occasionale, di masse cardiache o pseudo-masse.
Esse richiedono sicuramente una valutazione aggiuntiva, comprensiva di ecocardiogramma completo e consulenza cardiologica.
In generale, per massa si intende un’immagine in plus che occupa spazio in organo o struttura parenchimatosa o cava, là dove non dovrebbe esserci. Può essere di qualsiasi natura. Sono necessarie una definizione eziologica ed una caratterizzazione ecocardiografica delle masse cardiache. Quest’ultima comprende la definizione:
1. della sede;
2. della base d’impianto;
3. delle dimensioni;
4. del numero;
5. dell’ecostruttura;
6. del rapporto con le altre strutture cardiache.
La principale complicanza delle masse è l’embolizzazione nel circolo sistemico o polmonare. In generale, le “masse anormali” che possiamo visualizzare all’interno del cuore possono essere:
1. artefatti;
2. strutture fisiologiche, con varianti di forma o dimensione (talora abnormi);
3. neoplasie, benigne o maligne;
4. trombi;
5. vegetazioni;
6. device intracardiaci o elettrocateteri stimolatori.
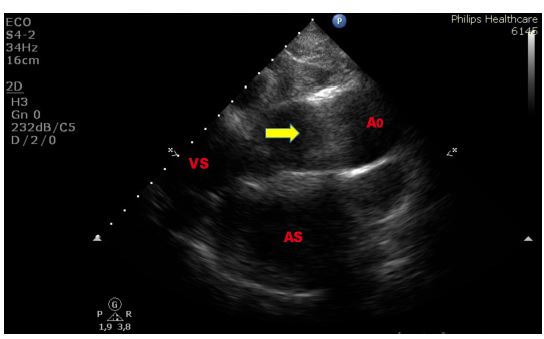
Gli artefatti si producono per tante ragioni e spesso sono provocati da strutture ad alta ecogenicità, fortemente riflettenti, come il metallo e le calcificazioni: gli ultrasuoni ritornano alla sonda e vengono rimandati nei tessuti. Di fronte ad ogni dubbio, la regola d’oro è quella di esaminare il reperto da diverse angolazioni: è quasi impossibile che un artefatto si ripresenti identico in proiezioni diverse.
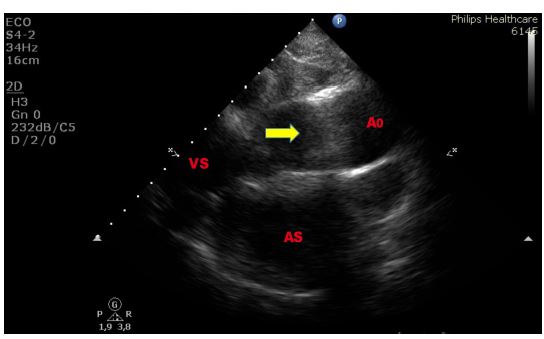
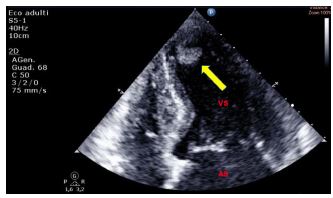
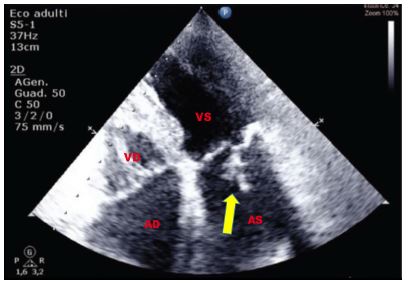
Figura 1. TTE (ecocardioscopia transtoracica), sezione parasternale “off-axis” per lo studio dell’aorta ascendente. Esempio di artefatto di riverberazione prodotto dalla parete anteriore dell’aorta ascendente intensamente ecogena nel tratto medio.
Pseudomasse cardiache
Includono residui embrionali come la rete di Chiari o la valvola di Eustachio; altre strutture non patologiche come falsi tendini, bande moderatrici, aneurismi del setto interatriale, l’ipertrofia lipomatosa del setto interatriale (SIA) ed infine le calcificazioni dell’anulus mitralico.
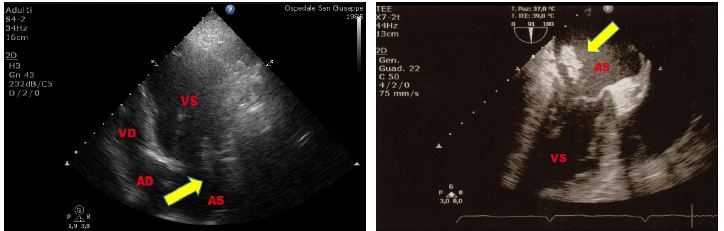
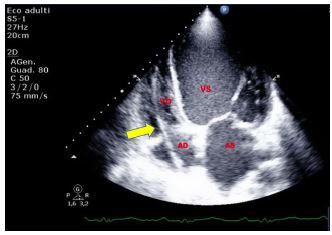
La valvola di Eustachio è una struttura membranosa e ondulata posta tra l’atrio destro e la vena cava inferiore (VCI). In alcuni individui, essa può essere prominente, e talmente ampia da causare ostruzione al flusso.
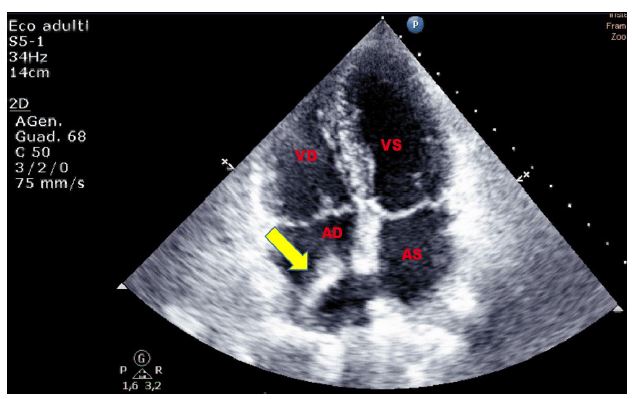
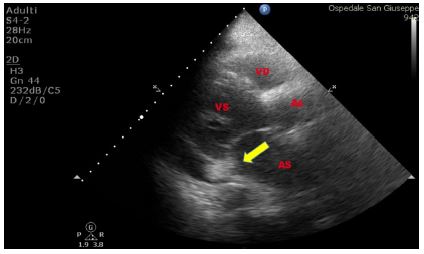
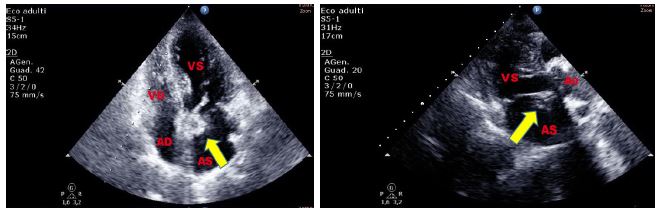
Figura 2. TTE, sezione apicale quattro camere. Esuberanza del tessuto della valvola di Eustachio in atrio destro, riscontrata in paziente donna di 60 anni, senza i comuni fattori di rischio cardiovascolare, giunta in PS per evento neurologico improvviso.
La rete di Chiari è costituita da fini strutture filamentose che sono il residuo di strutture embrionarie collocate all’interno dell’atrio destro e che sono dotate di una certa mobilità entro l’atrio destro. La valvola di Eustachio e la rete di Chiari, data la loro vicinanza alla valvola tricuspide, possono simulare vegetazioni tricuspidali o trombi provenienti dalla VCI.
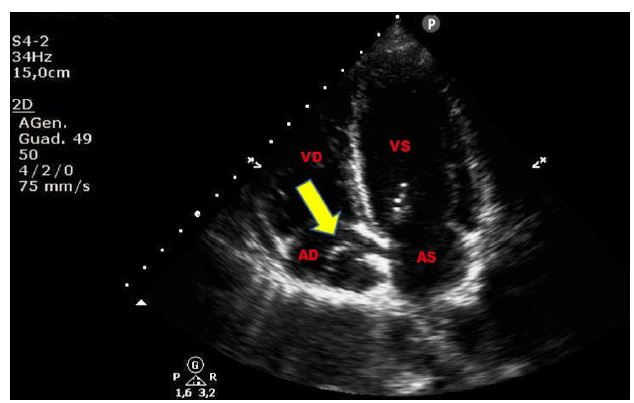
Figura 3. TTE, sezione apicale quattro camere. Paziente di 37 anni, giunto al PS per dispnea ingravescente, in recente storia di ipertensione polmonare primitiva. Evidente rete di Chiari in atrio destro. Reperto del tutto occasionale.
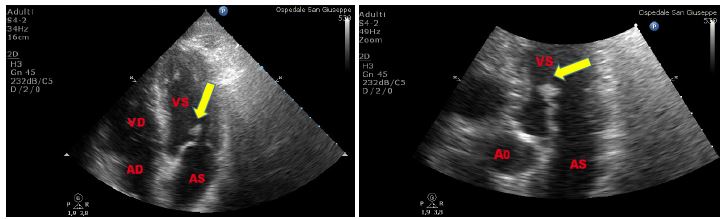
I falsi tendini del ventricolo sinistro sono formazioni anomale ma non necessariamente patologiche. Si tratta di strutture generalmente sottili tese tra due pareti ventricolari e senza rapporto con le strutture valvolari (il che le distingue dalle vere corde tendinee); sono costituiti da tessuto fibroso, fibre miocardiche e spesso cellule di Purkinije. La loro prevalenza nell’uomo è alta, 30-70% negli studi autoptici, da far considerare la loro presenza come
una variante del normale [7,8]. Tuttavia la presenza di tessuto di conduzione al loro interno e alcuni studi clinici hanno fatto ipotizzare una correlazione tra falsi tendini e aritmie ventricolari, anche se questa correlazione sembrerebbe riguardare solo una minoranza dei soggetti, in particolare quelli con falsi tendini più spessi o a decorso longitudinale [9].
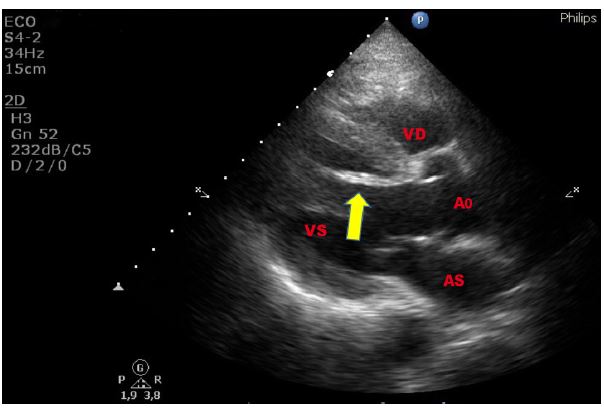
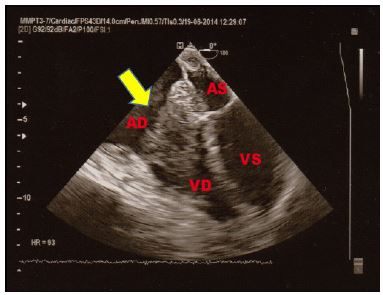
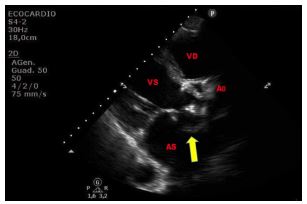
Figura 4. TTE, sezione parasternale asse lungo. Paziente asiatico, di 50 anni, giunto al PS per crisi ipertensiva e concomitante extrasistolia ventricolare in successione bigemina. Falso tendine intraventricolare sinistro, ad origine sub-aortica, decorso parallelo al SIV, ed inserzione in apice ventricolare sinistro. Reperto del tutto occasionale.
Il grasso si può accumulare in varie sedi all’interno del cuore, producendo una massa ecogena. Il setto interatriale (SIA) è una sede in cui il grasso tende ad accumularsi.
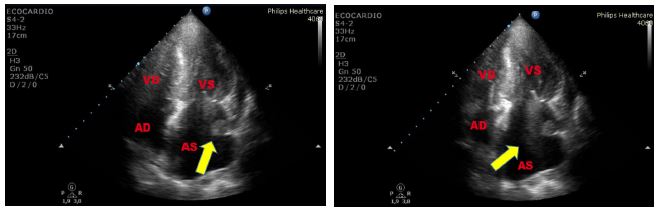
L’ipertrofia lipomatosa del SIA è una condizione di accumulo adiposo capsulato, localizzato a livello del SIA, riscontrabile più frequentemente negli obesi, negli anziani e nel sesso femminile [10]. Sembra essere associata a un’aumentata incidenza di aritmie sopraventricolari, coronaropatia e morte improvvisa [11]. Il SIA è insolitamente spesso e il grasso all’interno della struttura è ecogeno. La fossa ovale è spesso risparmiata dall’infiltrazione di grasso, conferendo all’ipertrofia del SIA una configurazione a manubrio, con agli estremi gli echi prodotti dal carico di grasso ed al centro un’eco sottile corrispondente alla fossa ovale.
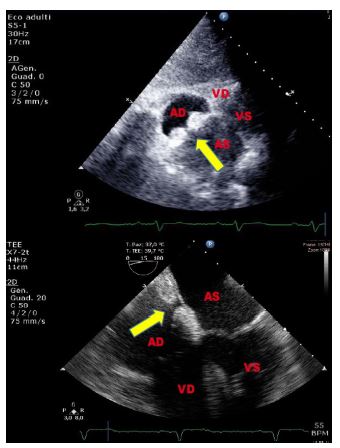
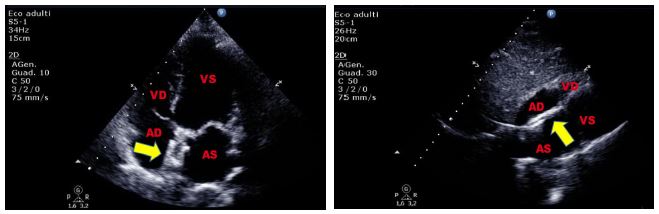
Figura 5. Paziente di 58 anni, affetta da sindrome di Bartter, giunta al PS per intensa astenia. Agli esami ematochimici riscontro di ipokaliemia severa. Pannello superiore:
TTE, sezione sottocostale quattro camere. Evidente ipertrofia lipomatosa bilobata del SIA che risparmia la fossa ovale. Pannello inferiore: TEE (ecocardiogramma transesofageo),
sezione quattro camere 15°. L’accumulo di grasso a livello del SIA risparmia la regione della fossa ovale.
Reperti ecocardiografici suggestivi di ipertrofia lipomatosa del SIA, reperto del tutto occasionale in questa paziente.
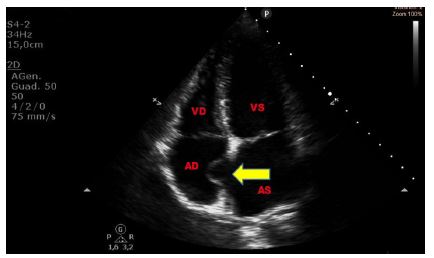
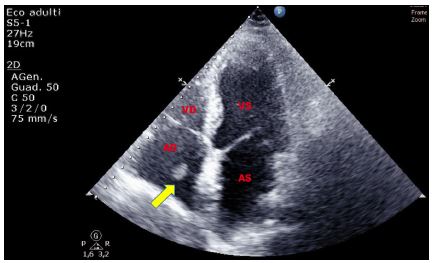
Anche un aneurisma del SIA può simulare una massa intracardiaca, anche se generalmente con un’attenta manipolazione della sonda per visualizzare la struttura in diverse sezioni ed eventualmente usando l’approccio transesofageo, è in genere possibile porre la diagnosi corretta. L’aneurisma del SIA si trova solitamente a livello della fossa ovale.
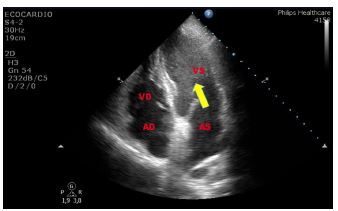
Figura 6. TTE, sezione apicale quattro camere. Aneurisma destro-convesso fisso del setto interatriale tipo 1R di Olivares-Reyes, in giovane donna di 30 anni giunta al PS per episodio di disartria di breve durata.
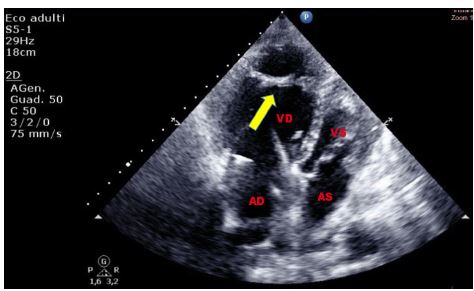
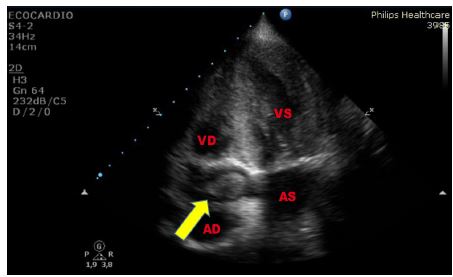
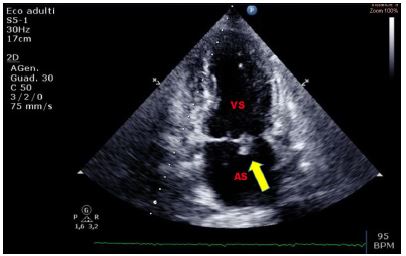
La banda moderatrice del ventricolo destro è una trabecolatura accentuata nel terzo apicale della cavità ventricolare destra, meglio visualizzata nella sezione quattro camere apicale. Poiché il ventricolo destro è di norma trabecolato, l’ipertrofia ventricolare destra accentua questa trabecolatura.
Figura 7. TTE, sezione apicale quattro camere. Banda moderatrice ipertrofica in paziente di 86 anni noto alla nostra Pneumologia per cuore polmonare cronico in stadio avanzato di scompenso, giunto al PS per dispnea ingravescente ed imponente edemizzazione declive.
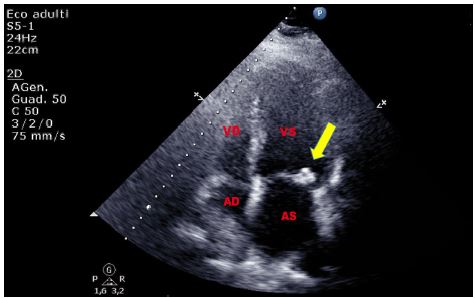
La calcificazione dell’anulus mitralico si presenta come una masserella iperecogena, in quanto calcifica, con movimenti sincroni con l’anulus, non vibratili, poco protrudenti all’interno della cavità (caratteristiche importanti per la diagnosi differenziale con masse patologiche come vegetazioni e tumori). È molto frequente nella popolazione sopra i 65 anni [12], e rappresenta la conseguenza della degenerazione dello scheletro fibroso dell’anulus. Essa è più frequente nelle donne, generalmente sopra i 70 anni, soprattutto se con insufficienza renale cronica. Altri fattori di rischio sono rappresentati dall’ipertensione arteriosa e dall’iperparatiroidismo primitivo. È più frequente a carico dell’anulus mitralico postero-laterale.
Figura 8. TTE, sezione apicale quattro camere. Grossolana calcificazione dell’anulus mitralico postero-laterale, in paziente di 80 anni, affetta da IRC ed ipertensione arteriosa, giunta al PS per crisi ipertensiva.
Neoplasie benigne o maligne
I tumori cardiaci possono essere primitivi (benigni o maligni) o secondari (nella maggioranza dei casi maligni). I tumori metastatici sono almeno 30 volte più frequenti di quelli primitivi, e pongono particolari problemi di diagnosi e approccio terapeutico [13].
Tra i tumori benigni, quelli di gran lunga più frequenti sono i mixomi. Sono tumori tipici dell’età adulta, più frequenti nelle donne che negli uomini (in un rapporto circa di 3:2) e si riscontrano soprattutto nell’atrio sinistro con la classica origine peduncolata dalla fossa ovale del SIA, anche se possono interessare ogni sede [14]. La presenza di un mixoma, clinicamente, si manifesta in circa l’80% dei casi con segni e sintomi analoghi a quelli
della valvulopatia mitralica o con fenomeni embolici, ma nel 16% dei casi il tumore è completamente asintomatico e risulta un reperto occasionale all’ecocardiografia. L’ecocardiografia ha cambiato radicalmente la prognosi di questo tumore, permettendo la diagnosi e quindi indirizzando i pazienti alla terapia chirurgica. Le dimensioni dei mixomi variano da uno a diversi centimetri [15]. La gran parte dei mixomi viene riconosciuta all’ecocardiografia
transtoracica; è opportuno però completare l’esame con l’approccio transesofageo, per escludere lesioni multiple (5% dei casi), per stabilire esattamente la sede e il tipo di inserzione e per meglio valutare le conseguenze emodinamiche delle masse più voluminose: queste variabili possono essere importanti per pianificare l’intervento chirurgico [16,17].
L’approccio transesofageo permette anche di valutare meglio la morfologia (margini regolari o polilobulati), l’ecogenicità (eventuali aree ipoecogene sono indicative di degenerazione cistica o emorragia intratumorale e sono utili nella diagnosi differenziale con i trombi, che non presentano questo fenomeno) e la motilità globale: queste caratteristiche possono aiutare a prevedere in parte quale sia il potenziale rischio emboligeno della massa e quindi l’urgenza dell’intervento chirurgico.
Figura 9. Paziente di 77 anni, diabetico, portatore di ICD monocamerale, giunto al PS per scompenso glicemico grave.
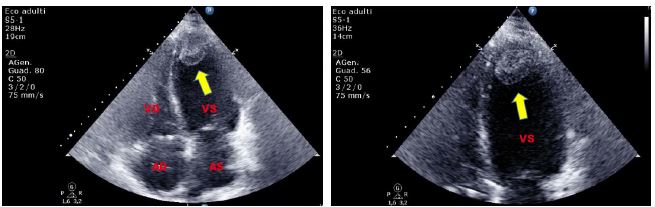
Pannello superiore. TTE, sezione apicale quattro camere. Massa digitiforme con ecogenicità simile a quella del miocardio, peduncolata, adesa alla parete postero-laterale dell’atrio sinistro, in vicinanza dell’anulus mitralico laterale, mobile e flottante nella cavità atriale sinistra fino all’orifizio valvolare mitralico. Reperto occasionale, suggestivo di mixoma atriale sinistro clinicamente silente.
Pannello inferiore. ETE, sezione due camere 91°: conferma della lesione mixomatosa peduncolata, con margini polilobulati, adesa alla parete postero-laterale dell’atrio sinistro, mobile e flottante nella cavità atriale sinistra fino all’orifizio mitralico, potenzialmente emboligena.
Figura 10. TTE, sezione apicale quattro camere. Massa ecogena rotondeggiante peduncolata, adesa alla parete libera dell’atrio destro, aggettante nella cavità atriale destra, senza ostruzione dell’ostio tricuspidale, da riferire a mixoma atriale destro. Riscontro occasionale in paziente grande anziana cachettica, giunta al PS con sintomi e segni di scompenso cardio-respiratorio avanzato.
Altro tumore benigno di interesse ecocardiografico è il fibroelastoma papillare. È localizzato nella maggior parte dei casi a livello valvolare e si presenta di solito come una piccola massa peduncolata originante da una cuspide valvolare. L’aspetto ecocardiografico è quello di una massa quasi sempre di piccole dimensioni (<20 mm nel diametro massimo), rotonda, ovale o irregolare, con bordi ben definiti e aspetto omogeneo, discretamente ecogena,
peduncolata e mobile in circa la metà dei casi [18,19]. Per il loro potenziale embolico, i fibroelastomi andrebbero rimossi chirurgicamente, anche se spesso sono scoperti incidentalmente in pazienti asintomatici. Il rischio di morte improvvisa è simile per i tumori ad origine valvolare (principalmente fibroelastomi) e per quelli intracavitari (prevalentemente mixomi) [20,21].
Figura 11. TTE, sezione apicale quattro camere apicale. Piccola massa ecogena ovalare, peduncolata, a partenza dal LAM, aggettante nella cavità ventricolare sinistra (pannello superiore) e nel tratto d’efflusso ventricolare sinistro (pannello inferiore), potenzialmente emboligena. Il paziente era giunto al PS per episodio di TIA. Tale massa è stata riferita a fibroelastoma del LAM.
I rabdomiomi rappresentano la maggioranza dei tumori primitivi cardiaci prima dei 15 anni (e comunque riscontrati quasi esclusivamente in giovane età); sono quasi sempre multipli e in un terzo dei casi sono associati con la sclerosi tuberosa [22,23]. In due terzi dei casi possono provocare aritmie o alterazioni emodinamiche dovute al loro volume, mentre in un terzo dei casi sono asintomatici; i tumori asintomatici sono quasi sempre associati alla sclerosi tuberosa [24]. Questi tumori molto raramente tendono a crescere, anzi spesso tendono alla remissione spontanea; l’indicazione chirurgica è limitata alle forme più gravi, sintomatiche [25,26].
Figura 12. TTE, sezione apicale quattro camere. Massa ecogena in corrispondenza della banda moderatrice del ventricolo destro in paziente di 36 anni, affetta da linfangioleiomiomatosi in sclerosi tuberosa, giunta al PS per insufficienza respiratoria. Tale massa è stata riferita a rabdomioma della banda moderatrice.
I tumori maligni secondari sono molto più frequenti di quelli primitivi; in base ai dati autoptici, il 10-20% dei pazienti deceduti con una neoplasia maligna hanno metastasi cardiache [27].
Non è facile distinguere tra i tumori benigni e quelli maligni. La caratteristiche da tenere in considerazione sono: l’impianto (quelli peduncolati e quelli originanti dai lembi valvolari sono nella maggior parte dei casi benigni), l’infiltrazione delle pareti e delle strutture vicine, la presenza di segni di insufficienza valvolare e la rapida crescita sono reperti che suggeriscono la malignità; anche la presenza di localizzazioni multiple e di versamento pericardico associato devono porre il sospetto di lesioni maligne [28].
Figura 13. TTE, sezione parasternale asse lungo. Moderata quota di versamento pericardico posteriore ed evidenza di massa ecogena peduncolata adesa al tetto atriale sinistro, aggettante nella cavità pericardica, in paziente di 85 anni, noto per adenocarcinoma polmonare avanzato, giunto al PS per dispnea ingravescente ed insufficienza respiratoria. Tale massa è stata interpretata come metastasi intrapericardica ad opera di tumore del polmone.
Figura 14. TEE, sezione quattro camere 0°. Imponente massa ecogena con struttura disomogenea (aree centrali ecoprive), a partenza dal setto interatriale, con larga base di impianto, che aggetta in atrio destro, occupa il piano valvolare tricuspidale ed infiltra gran parte del ventricolo destro. Ostruendo la valvola tricuspide, la massa produceva modificazioni emodinamiche importanti (venivano infatti riscontrati i rilievi Doppler di stenosi tricuspidale). Il paziente, di 74 anni, era giunto in PS per iperpiressia persistente da 4 settimane, non responsiva a terapia antibiotica, ed associata a dispnea ingravescente ed insufficienza respiratoria. Nel caso in questione, non è stato possibile eseguire l’ecocardioscopia transtoracica per la scadente finestra ecocardiografica. Pertanto, in considerazione del sospetto clinico iniziale di endocardite infettiva, il paziente è stato sottoposto direttamente a
TEE in Pronto Soccorso. La massa neoplastica, grazie al successivo esame citologico del versamento pleurico associato, si è rivelata un linfoma solido a cellule B del cuore destro, per cui il paziente è stato avviato al trattamento chemioterapico.
Trombi
I trombi si formano sull’endocardio quando c’è ristagno di sangue e quando la parete sottostante è acinetica. L’ecocontrastografia spontanea precede la formazione del trombo ed ha un valore prognostico paragonabile a quello di un trombo già formato [29,30]. Essa è caratterizzata da nubecole di deboli echi con movimenti lenti, simili a volute di fumo (smoke effect), che compaiono in condizioni di basso flusso e scompaiono quando il flusso aumenta. È un fenomeno che compare precocemente in caso di stasi. La sensibilità dell’eco transtoracico nell’individuare i trombi auricolari e l’ecocontrastografia spontanea nell’auricola rimane bassa [31].
Figura 15. TTE, sezione apicale quattro camere. Significativa quota di econtrasto spontaneo denso che occupa quasi tutta la cavità ventricolare sinistra, in paziente di 85 anni, affetto da scompenso cardiorespiratorio grave, giunto in PS per dispnea ingravescente e segni clinici congestizi.
Il trombo si presenta come una massa a margini ben definiti, visibile durante tutto il ciclo cardiaco, contigua ad una zona di miocardio acinetico. La maggioranza dei trombi ventricolari sono localizzati in prossimità dell’apice. L’analisi qualitativa e quantitativa dell’ecogenicità del trombo può fornire un’indicazione sulla sua età: i trombi recenti hanno un’ecogenicità granulare e un orletto iperecogeno, sono in genere protrudenti nella cavità e possono
avere il margine libero mobile; quelli più vecchi sono intensamente e uniformemente ecogeni (talora anche con aree calcifiche), possono assumere aspetto a stampo e sono immobili.
Lo studio degli aspetti morfologici del trombo è importante per valutare la possibilità di lisi ed il rischio embolico. I principali indici di rischio embolico sono: la protrusione del trombo e la motilità, che ne favoriscono il distacco almeno parziale; l’aspetto “fresco” può essere indice di attività trombogena; le modificazioni di forma nel tempo [32]. Con la terapia anticoagulante la percentuale di risoluzione del trombo è del 70%.
Figura 16. Pannello superiore e pannello inferiore: TTE, sezione apicale quattro camere. Grossolana formazione trombotica apicale sessile (a larga base di impianto), trombosi apicale “a palla”, con ecogenicità granulare ed orletto iperecogeno, aggettante nella cavità ventricolare sinistra, ipomobile, riscontrata in paziente diabetico di 70 anni, noto per scompenso cardiaco grave su base ischemica, giunto al PS per intensa astenia ed edemizzazione
declive.
Figura 17. TTE, sezione apicale quattro camere. Formazione trombotica apicale peduncolata con ecogenicità di tipo miocardico, ipermobile e aggettante nella cavità ventricolare sinistra, in paziente di 86 anni, con storia di pregresso IMA apicale, giunta al PS per la brusca comparsa di emiparesi destra ed afasia.
Nella genesi dei trombi dell’atrio sinistro la stasi ha generalmente un ruolo preponderante. Questo si rispecchia negli aspetti morfologici: la forma è di soluto globulare o a stampo, con base d’impianto nella maggior parte dei casi larga, con margini regolari o lobulati, e la sede è più spesso nell’auricola o a livello del tetto o della parete posteriore.
Nella diagnosi differenziale tra trombo e tumore, bisogna tenere presente il fatto che mentre il trombo non è vascolarizzato, il tumore è generalmente ipervascolarizzato.
Figura 18. Pannello superiore e pannello inferiore. TTE, sezione apicale quattro camere. Formazione trombotica globulare ipoecogena adesa all’ostio dell’auricola sinistra, sporgente nella cavità atriale sinistra (trombosi atriale sinistra), associata a significativa quota di ecocontrasto spontaneo, in paziente di 90 anni, trasferita al nostro PS da altra struttura per la brusca comparsa di emiparesi sinistra ed afasia.
Figura 19. TTE, sezione apicale quattro camere. Formazione ecogena peduncolata, adesa a dispositivo occlusore di PFO tipo Amplatzer, altamente
mobile e flottante nella cavità atriale destra. Il paziente di 75 anni, giunto al PS per dispnea ingravescente, era stato sottoposto circa un mese
prima a chiusura percutanea di PFO sintomatico per platipnea. Suddetta massa era riferibile in prima istanza a trombosi su device Amplatzer.
Vegetazioni o esiti di endocardite
La vegetazione è la lesione patologica fondamentale dell’endocardite infettiva. Si tratta di masserelle costituite da un agglomerato di fibrina e piastrine, in cui sono contenute cellule infiammatorie ed abbondanti patogeni. Sono masse di forma irregolare, ecogenicità variabile, distinte ma aderenti alla superficie di strutture cardiache, quali le valvole, il miocardio o device intracardiaci. Tipicamente si ritrovano sul versante atriale delle valvole atrioventricolari e su quello ventricolare della valvola aortica o polmonare.
Rispetto all’approccio transtoracico, quello transesofageo appare più sensibile e più specifico [33,34]. In presenza di vegetazioni di discrete dimensioni, già evidenti all’eco transtoracico, l’approccio transesofageo può essere utile per meglio definire dimensioni e motilità della vegetazione e quindi il suo potenziale embolico, la presenza di lesioni associate, come la perforazione dei lembi valvolari e la formazione di diverticoli, ascessi, aneurismi e tragitti fistolosi e l’entità della disfunzione valvolare. Per quel che riguarda i fattori predittivi del rischio embolico, gli studi effettuati con l’eco transtoracico e soprattutto con l’eco transesofageo hanno indicato un significativo aumento del rischio per vegetazioni >10 mm e per vegetazioni mobili [35]. Vegetazioni endocarditiche fresche hanno un’ecogenicità molto simile al miocardio. Invece, gli esiti fibrotici dell’endocardite hanno un aspetto iperecogeno e possono assumere una morfologia simile alle calcificazioni. Riportiamo due casi di endocardite infettiva (EI) su valvola mitrale nativa.
Figura 20. TTE, sezione apicale due camere. Formazione digitiforme con ecogenicità di tipo miocardico, adesa al lembo mitralico posteriore, altamente mobile e flottante tra la cavità atriale sinistra e quella ventricolare sinistra, in paziente di 60 anni, giunto al PS per iperpiressia dndd non responsiva alla terapia antibiotica. Suddetta massa è stata riferita ad endocardite infettiva su valvola mitralica nativa, con alto potenziale emboligeno.
Figura 21. TTE, sezione apicale quattro camere. Grossolana massa ecogena arborescente adesa all’anulus mitralico posterolaterale, con diametro longitudinale >10 mm, altamente mobile e flottante tra la cavità atriale sinistra e quella ventricolare sinistra, in paziente di 85 anni, nota per scompenso cardiaco cronico in valvulopatia mitralica degenerativa severa, giunta al PS per la brusca comparsa di disorientamento spazio-temporale ed emiparesi sinistra in iperpiressia persistente da due settimane. In considerazione delle caratteristiche cliniche della paziente (anziana e immunocompromessa) e delle dimensioni della formazione, quest’ultima è stata riferita in prima istanza ad endocardite fungina su apparato valvolare mitralico fibro-calcifico.
L’ascesso perivalvolare coinvolge più frequentemente la valvola aortica; va considerato presente quando c’è un ispessimento della parete aortica perivalvolare anteriore o posteriore >9 mm; è particolarmente frequente nelle endocarditi su valvola protesica (soprattutto meccanica); dato che in genere l’anulus è la sede primariamente coinvolta dalla infezione, l’ascesso si localizza prevalentemente attorno all’anello valvolare, a livello della continuità fibrosa intervalvolare mitro-aortica (a livello della giunzione tra la radice aortica e l’anulus mitralico). Essendo ripieno di materiale purulento, esso è costituito da materiale variamente ecodenso ed è delimitato da una capsula di tessuto fibroso iperecogeno; all’interno possono ritrovarsi aree ipoecogene colliquate.
Figura 22. Paziente di 75 anni, portatrice di protesi biologica aortica impiantata alcuni anni prima, giunta al PS per iperpiressia dndd, non responsiva alla terapia antibiotica. Pannello superiore: TTE, sezione quattro camere apicale. Pannello inferiore: TTE, sezione parasternale asse lungo. Circoscritto ispessimento della parete aortica peri-protesica posteriore, che si estende fino alla base del LAM, non in comunicazione con il lume aortico. In considerazione del contemporaneo riscontro di vegetazione endocarditica ipermobile adesa alla cuspide protesica posteriore, tale formazione è stata riferita ad ascesso periprotesico aortico posteriore. Nelle due immagini è evidente la capsula di tessuto fibroso iperecogeno, localizzata in corrispondenza della continuità fibrosa intervalvolare mitro-aortica; all’interno dell’ascesso (pannello inferiore) possono intravedersi aree ipoecogene colliquate.
La presenza di uno spazio vuoto è indicativa di uno stadio successivo con completa colliquazione e svuotamento dell’ascesso in cavità vicine o nel torrente circolatorio; la presenza di flusso con il colorDoppler nello spazio ascessuale indica la rottura dell’ascesso e la continuità con il flusso ematico; si viene così a formare uno pseudoaneurisma. Esso appare come cavità libera di echi appena sotto l’anulus aortico, compresa tra la base del LAM e la radice aortica posteriormente. Lo pseudoaneurisma, essendo rifornito dal flusso sanguigno sistolico proveniente dal tragitto fistoloso comunicante con le cavità cardiache, a differenza dell’ascesso, risulta pulsatile durante il ciclo cardiaco. Gli pseudoaneurismi della fibrosa intervalvolare mitro-aortica possono espandersi progressivamente e rompersi drammaticamente nel pericardio con tamponamento acuto e morte; più frequentemente lo pseudoaneurisma può rompersi in atrio sinistro.
Figura 23. Paziente di 85 anni, con storia di pregressa endocardite infettiva su bioprotesi aortica trattata presso altro Centro con terapia medica, giunto al nostro PS per dispnea ingravescente ed edemi declivi. TTE, sezione parasternale asse lungo. Formazione a semiluna con spazio centrale ecoprivo, localizzata posteriormente all’anulus aortico, tra la radice aortica e la base del LAM, con espansione sistolica e collasso diastolico, riferibile in prima istanza a pseudo-aneurisma della fibrosa intervalvolare mitro-aortica in recente EI su bioprotesi aortica. Nell’immagine in questione è evidente lo pseudoaneurisma in sistole (cavità non collassata).
Device intracardiaci o elettrocateteri stimolatori
I dispositivi usati per la chiusura percutanea del PFO hanno struttura ad ombrellino con scheletro metallico e sono pertanto iperecogeni.
Figura 24. Paziente di 38 anni giunta al PS per crisi ipertensiva. La paziente aveva eseguito alcuni mesi prima chiusura percutanea di PFO sintomatico per TIA ricorrenti con device Amplatzer. Pannello superiore: TTE, sezione apicale quattro camere. Pannello inferiore: TTE, sezione sottocostale quattro camere; si noti come il disco atriale sinistro sia più piccolo del disco atriale destro.
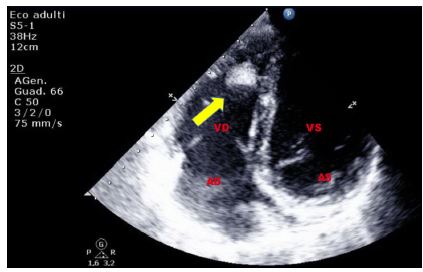
Gli elettrocateteri stimolatori di un pacemaker sono visibili nelle sezioni destre come strutture lineari o come pallini, a seconda del piano di sezione; possono causare artefatti.
Figura 25. TTE, sezione apicale quattro camere. Catetere stimolatore endocavitario destro in paziente di 82 anni, affetto da miocardiopatia dilatativa-ipocinetica, giunto al PS per dispnea ingravescente ed edemizzazione declive. Il paziente aveva eseguito un impianto di ICD monocamerale alcuni mesi prima. L’iperecogenicità, il decorso e la presenza di un’immagine “a binario” permettono il riconoscimento dell’elettrocatetere.
Legenda delle figure
AS = atrio sinistro
VS = ventricolo sinistro
AD = atrio destro
VD = ventricolo destro
Ao = aorta ascendente
Bibliografia
1. Spencer KT, Kimura BJ, Korcarz CE, Pellikka PA, Rahko PS, Siegel RJ. Focused Cardiac Ultrasound: Recommendations from the American Society of Echocardiography. J Am Soc Echocardiogr 2013; 26: 567-81.
2. American College of Emergency Physicians. Use of ultrasound imaging by emergency physicians. Policy 400121. Available at: http://www.acep.org (accessed November 1, 2009).
3. American College of Emergency Physicians. Emergency ultrasound guidelines 2008. Available at: http://www.acep.org (accessed November 1, 2009).
4. American College of Emergency Physicians. Emergency ultrasound imaging compendium 2006. Available at: http://www.acep.org (accessed November 1, 2009).
5. Society for Academic Emergency Medicine. Ultrasound position statement. Available at: http://www.saem.org (accessed November 1, 2009).
6. American College of Surgeons. Advanced trauma life support for physicians. American College of Surgeons, Chicago, IL,1997.
7. Luetmer PH, Edwards WD, Steward JB, TajiK AJ. Incidence and distribution of left ventricular false tendons: an autopsy study of 483 normal human hearts. J Am Coll Cardiol 1986; 8: 179-83.
8. Kervancioglu M, Ozbag D, Kervancioglu P, Hatipoglu ES, Kilic M, Yilmaz F, Deniz M. Echocardiographic and morphologic examination of left ventricular false tendons in human and animal hearts. Clin Anat 2003; 16: 389-95.
9. Lin FC, Wen MS, Wang CC, Yeh SJ, Wu D. Left ventricular fibromuscolar band is not a specific substrate for idiopathic left ventricular tachycardia. Circulation 1996; 93: 525-528.
10. Heyer CM, Kagel T, Lemburg SP, Bauer TT, Nicolas V. Lipomatous hypertrophy of the interatrial septum: a prospective study of incidence, imaging findings, and clinical symptoms. Chest 2003; 124: 2068-73.
11. Shirani J, Roberts WC. Clinical, electrocardiographic and morphologic features of massive fatty deposits (“lipomatous hypertrophy”) in the atrial septum. J Am Coll Cardiol 1993; 22: 226-38.
12. Aronow WS, Kronzon I. Correlation of prevalence and severity of mitral regurgitation and mitral stenosis determined by Doppler echocardiography with physical signs of mitral regurgitation and mitral stenosis in 100 patients aged 62 to 100 years with mitral anular calcium. Am J Cardiol 1987; 60: 1189-90.
13. McAllister H, Hall RJ, Cooley DA. Tumors of the heart and pericardium. Curr Problems Cardiol 1999; 24(2): 58-116.
14. Butany J, Naseemuddin A, Nair GM et al. Cardiac tumours: diagnosis and treatment. Lancet Oncol 2005;6:219-28.
15. Malekzadeh S, Roberts WC. Growth rate of left atrial myxoma. Am J Cardiol 1989; 64: 1075-76.
16. Jelic J, Milicic D, Alfirevic I et al. Cardiac myxoma: diagnostic approach, surgical treatment and follow-up. A twenty years experience. J Cardiovasc Surg 1996; 37(6 Suppl 1): 113-17.
17. Selkane C, Amahzoune B, Chavanis N et al. Changing management of cardiac myxoma based on a series of 40 cases with long-term follow-up. Ann Thorac Surg 2003; 76: 1935-38.
18. Sun JP, Asher CR, Yang XS, Cheng GG, Scalia GM et al. Clinical and echocardiographic characteristics of papillary fibroelastomas: a retrospective and prospective study in 162 patients. Circulation 2001; 103: 2687-93.
19. Davoli G, Bizzari F, Tucci E et al. Double papillary fibroelastoma of the aortic valve. Tex Heart Inst J 2004; 31: 448-49.
20. Bossert T, Gummert JF, Mohr F. Papillary fibroelastomas and other cardiac tumors should be resected on a urgent basis. Ann Thorac Surg 2005; 79: 756.
21. Edward FH, Hale D, Cohen A et al. Primary cardiac valve tumors. Ann Thorac Surg 1991; 52: 1127-31.
22. Elderkin RA, Radford DJ. Primary cardiac tumours in a pediatric population. J Paediatr Child Health 2002; 38: 173-77.
23. Liang CD, Ko SF, Huang SC. Echocardiographic evaluation of cardiac rhabdomyoma in infants and children. J Clin Ultras 2000; 28: 381-86.
24. Abushaban L, Denham B, Duff D. 10 year review of cardiac tumours in childhood. Br Heart J 1993; 70: 166-169.
25. Smythe JF, Dyck JD, Smallhorn JF et al. Natural history of cardiac rhabdomyoma in infancy and childhood. Am J Cardiol 1990; 66: 1247-1249.
26. Holley DG, Martin GR, Brenner JI et al. Diagnosis and management of fetal cardiac tumors: a multicenter experience and review of published reports. J Am Coll Cardiol 1995; 26: 516-520.
27. Bar-Sela G, Weyl Ben Arush M, Reisnerr S et al. Atrial metastasis detected by two-dimensional echocardiography. Acta Oncologica 2004; 43: 87-90.
28. Maillet-Vioud C, Bertrand B, Tribouilloy C et al. Apport de l’echocardiographie transesophagienne au cours des tumeurs cardiaques et paracardiaques. Etude multicentrique. Arch Mal Coeur Vaiss 1995; 88: 1307-1313.
29. Wang XF, Cheng TO, Li ZA, Deng YB, Wang JE. The relationship between intracardiovascular smoke-like echo and erythrocyte rouleaux formation. Am Heart J 1992; 124: 961-965.
30. Castello R, Pearson AC, Labovitz AJ. Prevalence and clinical implications of atrial spontaneous contrast in patients undergoing transesophageal echocardiography. Am J Cardiol 1990; 65: 1149-53.
31. Carerj S, Trifirò MP, Granata A, Luzza F, Arrigo F, Oreto G. Comparison between transesophageal echocardiography and harmonic tissue imaging for left atrial appendage assessment. Clin Cardiol 2002; 25: 268-70.
32. Johannessen KA, Nordreahug JE, Von-Der-Lippe G et al. Risk factors for embolization in patients with left ventricular thrombi and acute myocardial infarction. J Am Coll Cardiol 1989; 13: 554-564.
33. Birmingham GD, Rahko PS, Ballantyne F. Improved detection of infective endocarditis with transesophageal echocardiography. Am Heart J 1992; 123: 774-781.
34. Muegge A, Danile WG, Frank G, Lichtlen PR. Echocardiography in infective endocarditis: reassessment of prognostic implications of vegetation size determined by the trans-thoracic and the trans-esophageal approach. J Am Coll Cardiol 1989; 14: 631-38.
35. Deprele C, Bertelot PH, Lemetayer F et al. Risk factors for systemic emboli in infective endocarditis. Clin Microbiol Infect 2004; 10: 46-53.